Khí metan là gì? Điều chế, tính chất, ứng dụng của metan CH4
30/06/2021
Metan là gì? Tính chất hóa học của metan? Cách điều chế metan trong phòng thí nghiệm như thế nào? Tất cả sẽ được giải đáp trong nội dung bài viết dưới đây.
Mục lục bài viết
Khí metan hay Metan là gì?
Khí metan là hydrocacbon đơn giản nhất nằm trong dãy đồng đẳng ankan có công thức hóa học là CH4. Nó là thành phần chính của khí tự nhiên, khí dầu mỏ, khí bùn ao và khí đầm lầy. Hồ chứa khí metan lớn nhất nằm ở dưới đáy biển dưới dạng Clathrat metan.
Trong khí quyển, khí metan gây hiệu ứng nhà kính vì nó thúc đẩy sự oxy hóa hơi nước ở tầng bình lưu. Điều này gây hiệu ứng nhà kính mạnh hơn nhiều so với hiệu ứng trực tiếp mà khí metan gây ra. CH4 + OH → CH3 + H2O
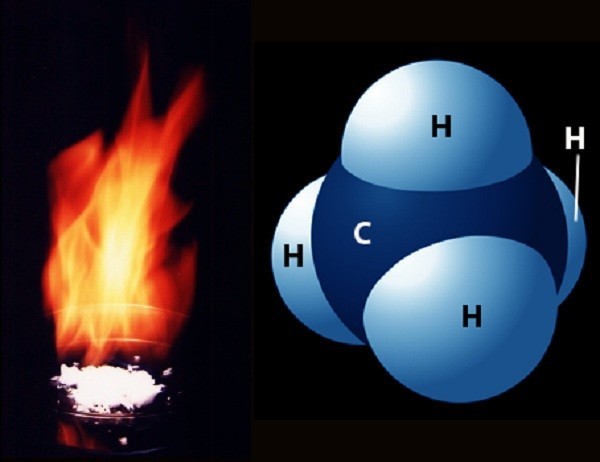
Khí metan là gì
Trong tự nhiên khí metan CH4 có ở đâu?
Khí metan là sản phẩm sinh ra từ các quá trình sinh học như lên men trong đường ruột của con người và các loài động vật.
Metan CH4 có nhiều trong những đám cháy rừng và đốt nhiên liệu hóa thạch.
Khí metan là một trong những thành phần chính của khí tự nhiên, khí dầu mỏ… và trong công nghiệp, nó là sản phẩm của quá trình chế biến dầu mỏ và chưng cất than đá.
Là sản phẩm của quá trình lên men yếm khí các chất thải có trong hầm cầu và nó cũng có nhiều trong các giếng sâu.
Mật độ CH4 ở bán cầu Bắc cao hơn vì nơi đây có nhiều nguồn metan thiên nhiên và nhân tạo hơn. Vào cuối mùa hè, mật độ của metan là thấp nhất.

khí metan có từ đâu
>> Xem thêm: Khí H2S là gì? Cách nhận biết, ứng dụng, tác hại của khí hidro sunfua
Tính chất vật lý của khí metan
Ở điều kiện tiêu chuẩn, metan là chất khí không màu không mùi, không vị, không dẫn điện và rất độc. Trong công nghiệp, metan thường được kết hợp với các hợp chất chứa lưu huỳnh có mùi mạnh để người dùng dễ dàng phát hiện nếu rò rỉ xảy ra.
Dễ bắt cháy và khi cháy sẽ tạo ra ngọn lửa màu xanh.
Nhiệt độ hóa lỏng là −162 °C và hóa rắn là −183 °C.
Điểm bốc cháy: 537 °C.
Khối lượng riêng: 0.717 kg/m3.
Độ tan: Tan trong dung môi không phân cực nhưng không tan trong các dung môi phân cực vì không có sự liên kết giữa các hydro.
Tính chất hóa học của khí metan
- Phản ứng thế với halogen
Metan phản ứng với các halogen tạo thành dẫn xuất halogen và hydro halogenua.
Ví dụ như trong ánh sáng khuếch tán , metan phản ứng với Clo theo nhiều giai đoạn:
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
- Phản ứng với hơi nước tạo ra khí CO trong điều kiện nhiệt độ 1000 °C và có chất xúc tác Niken
CH4 + H2O → CO + H2O
- Phản ứng oxy hóa hoàn toàn
CH4 + 2O2 → CO2 + 2H2O + Q
Q= −891 kJ/mol ở 25 °C, 1 atm
- Phản ứng cháy không hoàn toàn
Được ứng dụng trong sản xuất fomanđehit, bột than, khí đốt,…
200 atm, 300 °C: CH4 + O2 → HCHO + H2O
500 °C, xúc tác Niken: CH4 + O2 → 2CO + 4H2
Đốt trong điều kiện thiếu không khí: CH4 + O2 → C + H2O
- Phản ứng nhiệt phân
CH4 bị nhiệt phân bằng cách nung nóng nhanh với một lượng nhỏ oxy ở 1500 °C:
CH4 → C2H2 + 3H2 (Q = 397kJ/mol)
Oxy được dùng để đốt cháy một phần metan và cung cấp thêm nhiệt lượng cho phản ứng.
- Phản ứng phân hủy
Bị phân hủy ở nhiệt độ trên 1000 °C:
CH4 → C + 2H2
hoặc khi tác dụng với clo (đun nóng) hoặc Flo (điều kiện thường) để tạo thành muội than và khí axit:
CH4 + 2Cl2 → C + 4HCl
Cách điều chế metan trong phòng thí nghiệm
Trong phòng thí nghiệm, chúng ta có thể điều chế một lượng nhỏ khí metan bằng một trong những cách sau:
Điều chế từ nhôm cacbua:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑
Al4C3 + 12HCl → 4AlCl3 + 3CH4↑
Nung muối natri axetat với xút ở nhiệt độ cao (nhiệt phân muối natri của axit carboxylic):
CH3–COONa + NaOH → CaO + Na2CO3 + CH4
Thực hiện phản ứng cộng hydro vào cacbon có xúc tác Niken và nhiệt độ (hiệu suất phản ứng rất thấp)
C + 2H2 → CH4
Điều chế từ khí CO có xúc tác nhiệt độ
CO + 3H2 → H2O + CH4
Khử các dẫn xuất methyl của các halogen, ancol hoặc carbonyl.
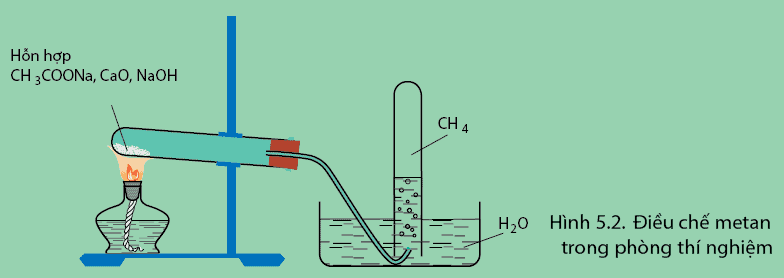
Điều chế CH4 trong phòng thí nghiệm
Ứng dụng của metan là gì?
Trong thực tế, khí metan có rất nhiều ứng dụng nhưng điển hình nhất vẫn là làm nhiên liệu. So với than đá, đốt cháy metan sinh ra ít khí cacbonic trên mỗi đơn vị nhiệt giải phóng hơn. Ngoài ra, ở nhiều quốc gia trên thế giới, khí metan được sử dụng để phục vụ cho việc sưởi ấm, nấu ăn và thường được biết tới với tên gọi là khí thiên nhiên.
Bên cạnh đó, metan cũng được dùng trong nhiều phản ứng hóa công nghiệp và có thể được vận chuyển dưới dạng khí hóa lỏng. Nó cũng là nguyên liệu để sản xuất nhiều chất khác như khí hydro, methanol, axit axetic và anhydrit axetic.

Ứng dụng của metan
Vậy là chúng ta đã tìm hiểu xong khí metan là gì cũng như cách điều chế và ứng dụng của nó trong cuộc sống. Hiện nay Vietchem chuyên cung cấp các loại vật tư xử lý khói khí thải phát thải từ các nhà máy công nghiệp. Với 20 năm hình thành và phát triền Vietchem cam kết mang đến cho khách hàng những sản phẩm chất lượng nhất, giá thành tốt nhất, giao hàng nhanh chóng, dịch vụ hậu mãi tuyệt vời. Nếu có nhu cầu mua hàng quý khách có thể truy cập website https://ammonia-vietchem.vn/ hoặc liên hệ 0963 029 988 để được báo giá tốt.
Cảm ơn sự quan tâm theo dõi của bạn đọc và chúng tôi rất mong nhận được những ý kiến đóng góp của các bạn để bài viết hoàn thiện hơn.
Tham khảo:











