Quá trình đẳng áp – Wikipedia tiếng Việt
Quá trình đẳng áp (tên tiếng Anh là isobaric process) là 1 quá trình nhiệt động lực học trong đó áp suất là 1 hằng số (không đổi theo thời gian). Trong nhiệt động lực học, nhiệt độ truyền vào trong chất khí có thể thay đổi nội năng và đồng thời sinh công:
- Q. = Δ U + A { \ displaystyle Q = \ Delta U + A \, }
Theo định luật 1 về nhiệt động lực học, nếu thể tích của khí tăng lên thì công được sinh ra do sự dãn ra ( tăng thể tích ) của khí, đơn cử như sau :
-
A
=
p.
△
V{\displaystyle A=p\,.\bigtriangleup V\,}
Bạn đang đọc: Quá trình đẳng áp – Wikipedia tiếng Việt
Chất khí tăng thể tích lên trong một khoảng cách nhỏ :
- d W = F d x { \ displaystyle dW = F \, dx \, }
và:
F
=
p
S
{\displaystyle F=p\,S\,}

=>
d
W
=
p
S
d
x
{\displaystyle dW=p\,S\,\,dx\,}

S
d
x
=
d
V
{\displaystyle S\,dx\ =dV}

=>
d
W
=
p
d
V
{\displaystyle dW=p\,dV\,}

Tích phân cả hai vế
- W = ∫ p d V { \ displaystyle W = \ int \ ! p \, dV \, }
W = p Δ V { \ displaystyle W = p \ Delta V \ }
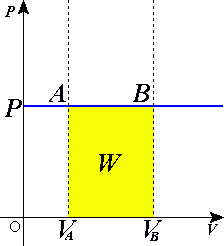 Biểu đồ quy trình đẳng áp
Biểu đồ quy trình đẳng áp
Trong chất khi lý tưởng:
p
V
=
n
R
T
{\displaystyle p\,V\ =n\,R\,T\ }

p
Δ
V
=
n
R
Δ
T
{\displaystyle p\Delta V\ =n\,R\Delta T\ }

R
=
8.31
J
m
o
l
K
{\displaystyle R=8.31{J \over mol}K}
và
V
1
V
2
=
T
1
T
2
{\displaystyle {V1 \over V2}={T1 \over T2}}

Vậy ta có được biểu thức
W
=
n
R
Δ
T
{\displaystyle W=n\,R\Delta T\,}

Dựa vào quá trình đẳng tích, giữa quá trình không có sự truyền nhiệt của các phản ứng hóa học, ta thu được sự liên hệ giữa độ thay đổi nội năng phụ thuộc vào nhiệt độ như sau:
Δ
U
=
n
C
v
Δ
T
{\displaystyle \Delta U\ =n\,C_{v}\Delta T\ }

C
v
{\displaystyle \,C_{v}\ }

C
v
=
3
2
R
{\displaystyle \,C_{v}\ ={3 \over 2}R}

Khi áp suất không đổi,
Q
=
n
C
p
Δ
T
{\displaystyle Q=n\,C_{p}\Delta T\ }

C
p
{\displaystyle \,C_{p}\ }

Từ định luật 1 nhiệt động lực học ta có:
- Q = n C v Δ T + W { \ displaystyle Q = n \, C_ { v } \ Delta T \ + W }
- Q = n C v Δ T + n R Δ T { \ displaystyle Q = n \, C_ { v } \ Delta T \ + n \, R \ Delta T \ }
- Q = n ( c V + R ) Δ T { \ displaystyle Q = n \, ( c_ { V } + R ) \, \ Delta T }
- n C p Δ T = n ( c V + R ) Δ T { \ displaystyle n \, C_ { p } \ Delta T \ = n \, ( c_ { V } + R ) \, \ Delta T }
-
C
p
=C
v
+
R{\displaystyle \,C_{p}\ =\,C_{v}\ +R}
Xem thêm: 99+ Câu đố về quả kèm đáp án
- C p = 3 2 R + R = 5 2 R { \ displaystyle \, C_ { p } \ = { 3 \ over 2 } R + R = { 5 \ over 2 } R }
[1]
- ^ a b “Patana”. Bản gốc lưu trữ ngày 4 tháng 7 năm 2011.
- ^ Principles of Physics, trang 621
Source: https://mix166.vn
Category: Hỏi Đáp





















