Năng lượng của các electron trong nguyên tử
Mục lục bài viết
Trong nguyên tử, các electron chiếm các obitan theo tứ tự tăng dần mức năng lượng. Sự phân bố electron trong nguyên tử tuân theo nguyên lí Pau-li, nguyên lí vững bền và quy tắc Hun
Bạn đang đọc: Năng lượng của các electron trong nguyên tử
Năng lượng của các electron trong nguyên tử
I. Kiến thức cần nắm vững:
1. Năng lượng của electron trong nguyên tử:
– Trong nguyên tử, những electron nằm trên mỗi obitan có một mức năng lượng xác lập, được gọi là mức năng lượng obitan nguyên tử ( mức năng lượng AO ) .- Các electron trên những obitan khác nhau của cùng một phân lớp có năng lượng như nhau .Ví dụ : Phân lớp 2 p có 3 AO : 2 px, 2 py, 2 pz. Các electron của những obitan p này tuy có sự xu thế trong khoảng trống khác nhau, nhưng chúng có cùng mức năng lượng AO .- Trật tự những mức năng lượng obitan nguyên tử : Khi số hiệu nguyên tử Z tăng, những mức năng lượng AO tăng dần theo trình tự sau :1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s 5 f 6 d …- Khi điện tích hạt nhân tăng, có sự chèn mức năng lượng : mức 4 s trở nên thấp hơn 3 d, mức 5 s thấp hơp 4 d, 6 d thấp hơn 4 f, 5 d …
2. Các nguyên lí và quy tắc phân bố electron trong nguyên tử:
a. Nguyên lí Pau-li:
– Ô lượng tử : Để màn biểu diễn obitan nguyên tử một cách đơn thuần, người ta dùng những ô vuông nhỏ, được gọi là những ô lượng tử. Một ô lượng tử ứng với 1 AO .VD : n = 1 : chỉ có 1 AO-1s => trình diễn bằng 1 ô vuông
n = 2: có 1 AO-2s và 3 AO-2p => AO 2s được biểu diễn bằng 1 ô vuông ![]() , 3 AO-2p được biểu diễn bằng 3 ô vuông vẽ liền nhau
, 3 AO-2p được biểu diễn bằng 3 ô vuông vẽ liền nhau ![]()
– Nguyên lí Pauli: Trên 1 obitan chỉ có thể có nhiều nhất là 2electron và 2 electron này chuyển động tự quay khác chiều nhau xung quanh trục riêng của mỗi electron.
– Chiều tự quay khác nhau của 2 electron được trình diễn bằng 2 mũi tên nhỏ : 1 mũi tên có chiều đi lên, 1 mũi tên có chiều đi xuống .
+ Khi trong 1 obitan đã có 2 electron, gọi là các electron ghép đôi:![]() .
.
+ Khi obitan chỉ chứa 1 electron thì electron đó gọi là electron độc thân ![]()
– Số electron tối đa trong 1 lớp và 1 phân lớp :+ Số electron tối đa trong 1 lớp : 2 n2+ Số electron tối đa trong 1 phân lớp :
Phân lớp
Số AO
Số electron tối đa
Xem thêm: LÃO CỬU MÔN tập 1
Trạng thái electron tối đa ở lớp thứ n
s
1
2
ns2
p
3
6
np6
d
5
10
nd10
f
7
14
nf14
+ Các phân lớp s2, p6, d10, f14 có đủ số electron tối đa gọi là phân lớp bão hòa. Phân lớp chưa đủ số electron tối đa gọi là chưa bão hòa. Phân lớp có 1 nửa số electron tối đa s1, p3, d5, f7 gọi là bán bão hòa .
b. Nguyên lí vững bền:
– Ở trạng thái cơ bản, trong nguyên tử những electron chiếm lần lượt những obitan có mức năng lượng từ thấp đến cao .Ví dụ : Nguyên tử B có Z = 5, có 5 e sẽ phân bổ lần lượt vào những obitan : 1 s, 2 s, 2 p. Trong đó 2 e vào AO-1s, 2 e vào AO-2s và 1 e vào AO-2pBiểu diễn bằng ô lượng tử so với nguyên tử B :
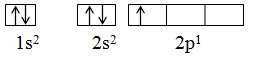
c. Quy tắc Hun:
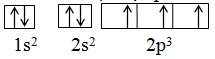
– Trong cùng 1 phân lớp, những electron sẽ phân bổ trên những obitan sao cho số electron độc thân là tối đa và những electron này phải có chiều tự quay giống nhau. Các e độc thân này được kí hiệu bằng những mũi tên cùng chiều, thường được viết hướng lên trên .
– Ví dụ : Nguyên tử N có Z = 7 : có 7 e, được phân bổ vào những AO : 1 s, 2 s, 2 p
Xem thêm: Một Số Ý Tưởng Sáng Tạo Khoa Học Kỹ Thuật Dành Cho, Những Sáng Chế Hay Của Học Sinh, Sinh Viên
Tất cả nội dung bài viết. Các em hãy xem thêm và tải file chi tiết dưới đây:
Luyện Bài tập trắc nghiệm môn Hóa lớp 10 – Xem ngay
Source: https://mix166.vn
Category: Công Nghệ











