Ankan: Tính chất vật lý, tính chất hóa học, ứng dụng và cách điều chế
Tailieumoi.vn biên soạn và giới thiệu các kiến thức lý thuyết trọng tâm bao gồm định nghĩa, tính chất, ứng dụng và
cách điều chế của ankan trong bài viết dưới đây, giúp học sinh ôn tập và bổ sung kiến thức cũng như hoàn thành tốt
các bài kiểm tra môn Hóa học. Mời các bạn đón xem:
1. Định nghĩa Ankan là gì?
Ankan là những hydrocacbon no dạng mạch hở, trong phân tử chỉ có liên kết đơn C-C hoặc C-H.
Ankan có công thức tổng quát là: CnH2n+2 (n ≥ 1).
Ankan đơn giản nhất là metan (CH4).
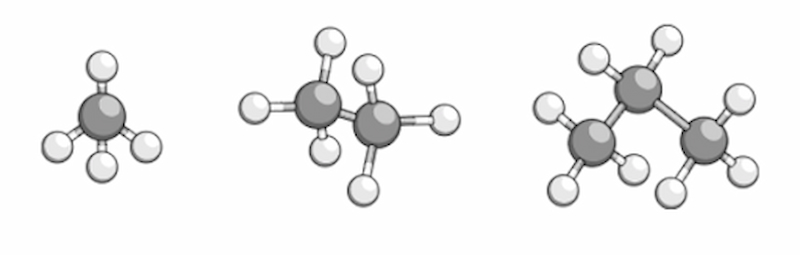
Ankan là gì? (Ảnh: Sưu tầm Internet)
2. Dãy đồng đẳng ankan
CH4 và các chất có công thức phân tử như C2H6, C3H8, C4H10, C5H12,… được gọi là dãy đồng đẳng ankan với
công thức tổng quát là CnH2n+2 (n ≥ 1).
Dãy đồng đẳng của ankan bao gồm:
CH4 : Metan
C2H6 : Etan
C3H8 : Propan
C4H10 : Butan
C5H12 : Pentan
C6H14 : Hexan
C7H16 : Heptan
C8H18 : Octan
C9H20 : Nonan
C10H22 : Decan
Mạch cacbon ở dạng mạch hở, có thể phân nhánh hoặc không phân nhánh.
Trong phân tử ankan, các nguyên tử cacbon trong không cùng nằm trên một đường thẳng (trừ C2H6).
Trong phân tử chỉ có liên kết đơn tạo thành từ 4 obitan lai hóa sp3 trong nguyên tử cacbon với định hướng kiểu tứ diện đều. Vì vậy, mạch cacbon có dạng gấp khúc và các nguyên tử cacbon có thể quay khá tự do xung quanh các liên kết đơn.
3. Đồng phân
Từ C4H10 trở đi, mỗi công thức phân tử sẽ ứng với các công thức cấu tạo mạch cacbon không phân nhánh và có phân nhánh của các đồng phân mạch cacbon.
Chẳng hạn, công thức phân tử C2H5 sẽ ứng với các chất đồng phân cấu tạo như sau:
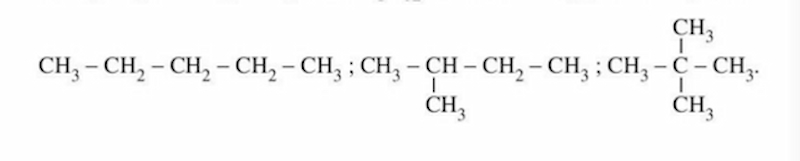
Đồng phân của C2H5. (Ảnh: Chụp màn hình SGK Hóa 11)
4. Danh pháp của ankan
Một số ankan mạch cacbon không phân nhánh với danh pháp khác nhau được giới thiệu trong bảng dưới đây:
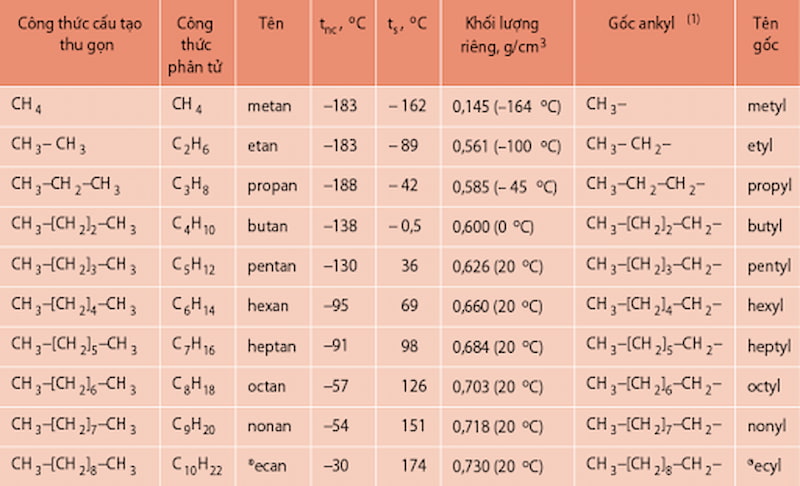 ‘
‘
Một số ankan mạch cacbon không phân nhánh. (Ảnh: Chụp màn hình SGK Hóa 11)
Tên gọi của ankan mạch thẳng
Tên gọi của ankan mạch thẳng = Tên mạch cacbon + an
Ví dụ:
CH4: Metan
C2H6: Etan
C3H8: Propan
C4H10: Butan
Tên gọi của ankan mạch nhánh
Tên gọi của ankan mạch nhánh = Vị trí mạch nhánh – tên nhánh + tên mạch chính + an. Trong đó:
Số mạch cacbon chính là mạch dài và có nhiều nhánh nhất.
Đánh số thứ tự các nguyên tử cacbon mạch chính bắt đầu từ phía gần nhánh hơn.
Gọi tên mạch nhánh (nhóm ankyl) theo thứ tự vần chữ cái cùng với số chỉ vị trí của nó, sau đó là ankan tương ứng
với mạch chính (chi tiết ở bảng trên).
Gốc hidrocacbon là phần còn lại của phân tử hidrocacbon sau khi bớt đi một số nguyên tử hidro nhưng vẫn tồn tại
trong phân tử ở trạng thái liên kết và không mang e tự do giống gốc tự do.
Công thức tổng quát nhóm ankyl là: CnH(2n+1)
Bậc của nguyên từ cacbon trong phân tử ankan bằng số nguyên tử cacbon liên kết trực tiếp với nó.
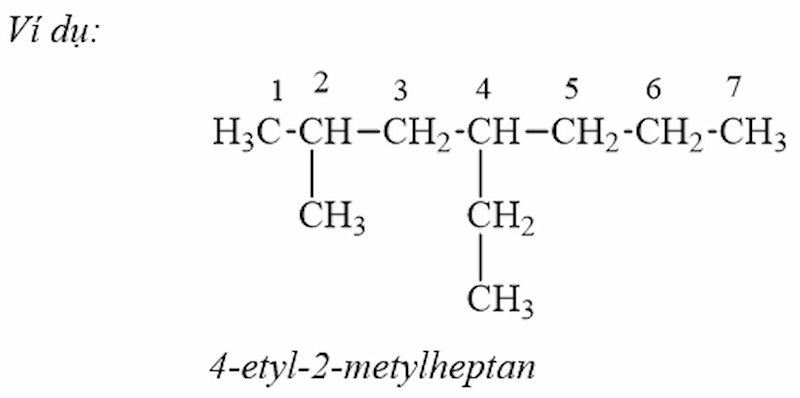
Ví dụ về pháp danh của ankan mạch nhánh (Ảnh: Sưu tầm internet)
Với trường hợp chỉ có 1 nhánh CH3 ở nguyên tử C số 2, ta thêm tiền tố iso ở cuối.
Với trường hợp có 2 nhánh CH3 ở nguyên tử C số 2, ta thêm tiền tố neo.
CH4: Metan
C2H6: Etan
C3H8: Propan
C4H10: Butan
5. Tính chất vật lý của ankan
Dưới đây là các tính chất của ankan về mặt vật lý mà bạn cần biết:
Ở điều kiện thường, 4 ankan đầu tiên trong dãy đồng đẳng (CH4 đến C4H10) tồn tại ở dạng khí. Các ankan tiếp theo là dạng lỏng và từ C18H38 trở đi ở dạng rắn.
Xét theo chiều tăng của phân tử khối, nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng của các ankan tăng dần.
Ankan nhẹ hơn nước, đa số ankan không tan trong nước mà chỉ tan trong dung môi hữu cơ.
Ankan là dung môi không phân cực, có thể hòa tan trong các chất không phân cực như benzen, dầu mỡ…
6. Tính chất hóa học của ankan
Trong nhiệt độ thường, các ankan không tác dụng với dung dịch axit, dung dịch kiềm và các chất oxi hóa. Nhưng khi
được đun nóng hoặc chiếu sáng, các ankan dễ dàng tham gia các phản ứng thế, phản ứng tách hidro và phản ứng
cháy. Cùng tìm hiểu tính chất hóa học của ankan thông qua 3 loại phản ứng điển hình nhất.

Tìm hiểu tính chất hóa học của ankan. (Ảnh: Sưu tầm Internet)
Phản ứng thế bởi halogen
Clo có thể thay thế lần lượt từng nguyên tử H trong phân tử metan:
CH4 + Cl2 → CH3Cl (clometan – metyl clorua) + HCl (ĐK: Ánh sáng)
CH3Cl + Cl2 → CH2Cl2 (điclometan- metylen clorua) + HCl (ĐK: Ánh sáng)
CH2Cl2 + Cl2 → CHCl3 (triclometan – clorofom) + HCl (ĐK: Ánh sáng)
CHCl3+Cl2 → CCl4 (tetraclometan- cacbon tetraclorua) + HCl (ĐK: Ánh sáng)
Các đồng đẳng của metan cũng tham gia phản ứng thế tương tự metan:
CH3-CH2-CH3 + Br2 → CH3-CHBr-CH3 + HBr (sản phẩm chính)
CH3-CH2-CH3 + Br2 → CH3-CH2-CH2-Br + HBr (sản phẩm phụ)
Đối với ankan có mạch cacbon từ 3 C trở lên, clo và brom sẽ ưu tiên thế H ở các cacbon có bậc cao tạo thành sản phẩm chính.
Vì ankan có phản ứng mãnh liệt với flo nên sẽ bị phân hủy thành C và HF: CnH2n+2 + (n+1)F2 → nC + (2n+2)HF
Ankan không phản ứng thế với Iot.
Khả năng phản ứng của dãy halogen với ankan giảm theo thứ tự: F2 > Cl2 > Br2> I2.
Nhận xét:
Nguyên tử hiđro khi liên kết với nguyên tử cacbon ở bậc cao hơn sẽ dễ bị thế hơn nguyên tử hiđro liên kết với
nguyên tử cacbon bậc thấp hơn.
Các sản phẩm thế được gọi là dẫn xuất halogen của hiđrocacbon.
Phản ứng tách
Dưới tác dụng của nhiệt và những chất xúc tác thích hợp, các ankan có phân tử khối nhỏ sẽ bị tách hiđro thành
hiđrocacbon không no tương ứng.
Ví dụ: CH3 – CH3 → CH2=CH2 + H2 (500 độ C, chất xúc tác)
Phương trình tổng quát: CnH(2n+2) → CnH2n + H2 (nhiệt độ, Fe)
Ở nhiệt độ cao và chất xúc tác thích hợp, ngoài việc bị tách hiđro, các ankan còn có thể bị phân cắt mạch cacbon tạo
thành các phân tử nhỏ hơn.
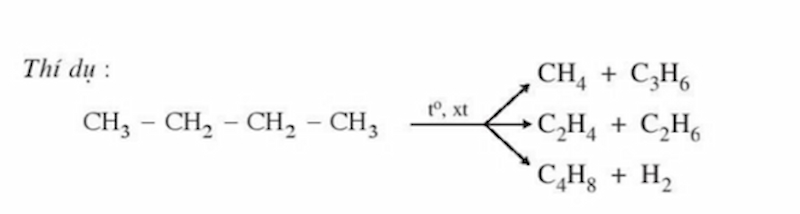
Lưu ý:
Những ankan có 2 nguyên tử C trở lên mới tham gia phản ứng tách H2.
Trong phản ứng này, 2 nguyên tử H với 2 nguyên tử C nằm cạnh nhau sẽ tách ra cùng nhau. Cần ưu tiên tách nguyên tử H ở nguyên tử C có bậc cao hơn. C4H10 → CH3 – CH=CH – CH3 + H2 (nhiệt độ Fe)
Phản ứng oxi hóa
Khi bị đốt, các ankan đều cháy và tỏa ra nhiều nhiệt theo công thức chung:
CnH2n+2 + (3n+1/2) O2 → nCO2 + (n+1) H2O
Nếu thiếu oxi, phản ứng cháy của ankan xảy ra không hoàn toàn: Sản phẩm cháy còn có C, CO,.. ngoài CO2 và nước.
Nhận xét:
Khi đốt ankan, ta thu được nCO2 < nH2O
Nếu đốt hiđrocacbon, ta thu được nCO2 < nH2O. Hiđrocacbon được đốt là ankan (CnH2n+2).
Mục lục bài viết
7. Điều chế ankan trong phòng thí nghiệm và trong công nghiệp
Đâu là cách ankan được tạo ra? Cùng Monkey tìm hiểu cách điều chế của hợp chất này trong 2 môi trường: Phòng
thí nghiệm và trong công nghiệp.
Điều chế ankan trong phòng thí nghiệm
Trong phòng thí nghiệm, metan được điều chế bằng cách đun nóng natri axetat khan với hỗn hợp vôi tôi xút theo
phương trình:
CH3COONa + NaOH → CH4↑ + Na2CO3 (ĐK: CaO, nhiệt độ)
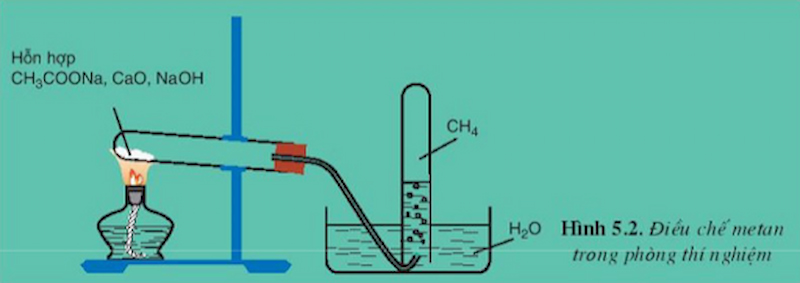
Điều chế metan trong phòng thí nghiệm. (Ảnh: Chụp màn hình SGK Hóa 11)
Điều chế ankan trong công nghiệp
Người ta tìm thấy một lượng lớn ankan (CH4, C2H6, C3H8, C4H10 …) trong dầu mỏ, khí dầu mỏ, khí thiên nhiên,… Thông qua phương pháp chưng cất phân đoạn, ankan trong công nghiệp thu được ở những phân đoạn chưng cất khác nhau.
-
C + 2H2 → CH4 (Ni, 500 độ C)
-
CO + 3H2 → CH4 + H2O (nhiệt độ, xúc tác)
8. Những ứng dụng của ankan phổ biến
Với những tính chất vật lý và hóa học trên, ankan mang lại những ứng dụng đa dạng và khác nhau trong thực tiễn
đời sống. Điển hình là:
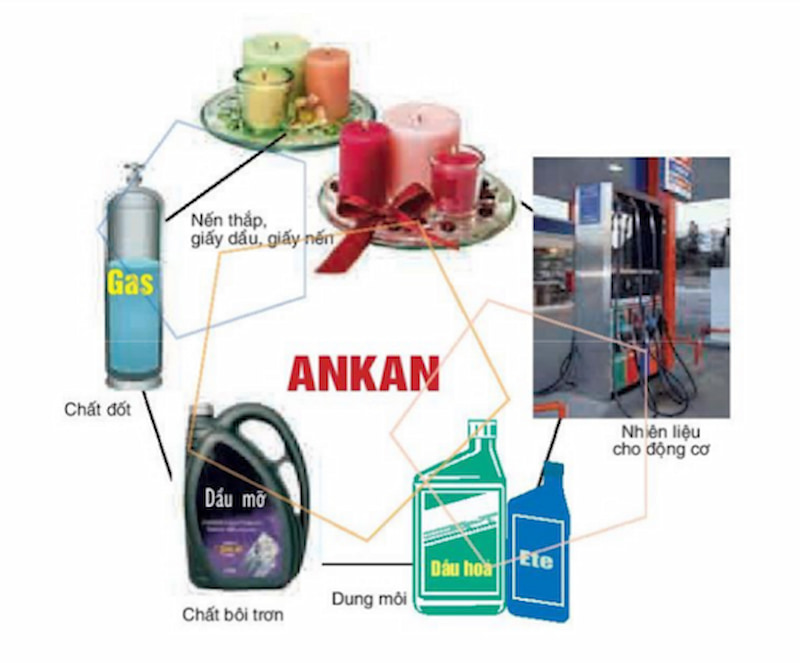
Tìm hiểu ứng dụng của ankan trong đời sống. (Ảnh: Chụp màn hình SGK Hóa 11)
Nhiên liệu trong hàn cắt kim loại.
Dầu bôi trơn và chất dung môi.
Được sử dụng để tổng hợp nhiều chất hữu cơ khác như: CH3Cl, CH2Cl2, CCl4, CF2Cl2, …
Đặc biệt, CH4 có thể ứng dụng để điều chế nhiều chất khác nhau như: Hỗn hợp CO + H2, ammoniac, C2H2, rượu metylic, andehit fomic, …











