Axit Clohidric là gì? Tính chất hóa học của HCl [CHI TIẾT]

Axit Clohidric là gì? Cấu tạo phân tử của HCl
Axit Clohidric là một axit vô cơ mạnh, nó tồn tại 2 dạng là lỏng và khí. Ở dạng lỏng, nó được tạo ra từ sự hòa tan của khí hydro clorua trong nước. Axit Clohydric có công thức hóa học là HCl. Ngoài ra, nó còn có tên gọi khác như axit hydrochloric, cloran, axit muriatic.
Theo trang Wikipedia HCl – Axit Clohidric hay axit muriatic là một axit vô cơ mạnh, tạo ra từ sự hòa tan của khí hydro clorua (HCl) trong nước. Axit Muriatic đậm đặc nhất có nồng độ tối đa là 40%. Ở dạng đậm đặc, axit này có thể tạo thành các sương mù axit, có khả năng ăn mòn các mô con người, gây tổn thương cơ quan hô hấp, mắt, da và ruột. Axit clohydric dạng hỗn hợp đẳng phí (khoảng 20,2%) có thể được dùng như một tiêu chuẩn cơ bản trong phân tích định lượng.

Axit Clohidric có tính chất vật lý như thế nào?
-
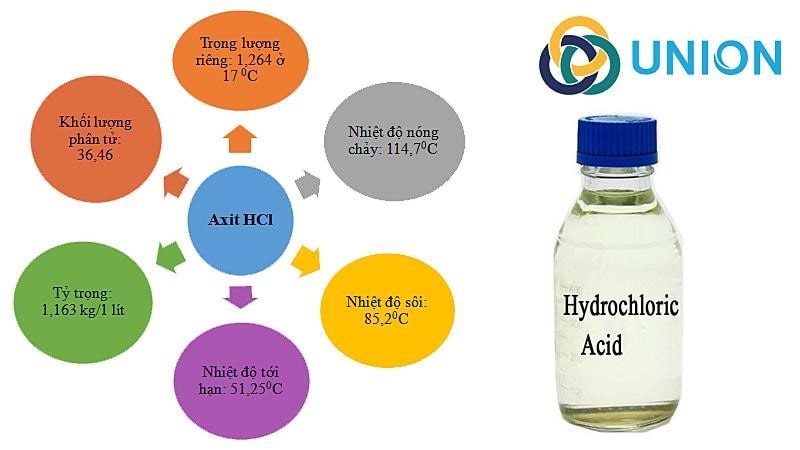
Dạng khí: không màu, mùi xốc, tan nhiều trong H2O tạo dung dịch axit mạnh, nặng hơn không khí.
-
Dạng dung dịch: HCl loãng không màu, HCl đậm đặc 40% màu vàng ngả xanh lá, có thể tạo thành sương mù axit.
-
Độ hòa tan trong nước: 725g/L ở 20 độ C.
-
Trọng lượng phân tử: 36,5 g/mol.
-
Dung dịch HCl dễ bốc cháy, bay hơi.
Tính chất hóa học của HCL – Axit Muriatic
Ở điều kiện thông thường, dung dịch Axit Muriatic là một chất lỏng không màu, trong suốt hoặc vàng nhạt (do lẫn hợp chất), có thể bốc khói hơi nhớt, nặng hơn nước. HCl mang đầy đủ tính chất hóa học của một axit mạnh. Cụ thể:
-
Làm thay đổi màu giấy quỳ tím
-
Là 1 chất điện li mạnh
-
Tác dụng với oxit kim loại, kim loại, bazơ, muối, các chất có tính oxi hóa cao.
1. HCl làm đổi màu chất chỉ thị
Là 1 axit mạnh, khi cho giấy quỳ tím nhúng vào dung dịch HCl sẽ chuyển từ không màu sang màu hồng đỏ. Đây cũng là cách phân biệt axit rõ ràng nhất, một trong những dấu hiệu nhận biết HCl. Hiện tượng thay đổi màu giấy quỳ tím chỉ xảy ra khi HCl tồn tại ở dạng dung dịch. Trường hợp chất này ở dạng khí thì không làm quỳ tím đổi màu.

2. HCl là chất điện li mạnh
Axit clohiđric là axit một nấc, tức nó có thể phân ly cho ra một ion H+ và một ion Cl−. Khi hòa tan trong nước, ion H+ liên kết với phân tử nước tạo thành H3O+ (ion hydronium). Phương trình như sau:
HCl + H2O → H3O+ + Cl–
Do phân ly hoàn toàn trong nước nên axit clohiđric được xếp vào nhóm axit mạnh. Các axit mạnh tương tự như HCl, thì hằng số điện ly Ka có giá trị lớn, tùy theo nguồn, dao động trong khoảng -3 đến -7, thậm chí đến -9,3.
3. Axit Muriatic có tính chất oxi hóa hay tính khử?
Axit Muriatic có cả tính oxi hóa và cả tính khử:
-
Tính oxi hóa: Axit Clohidric tác dụng với các kim loại đứng trước H2 trong bảng tuần hoàn.
-
Tính khử: Axit Clohidric tác dụng với chất có tính oxi hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3, …
Phương trình phản ứng như sau:
2HCl + MnO2 → MnCl2 + Cl2↑ + H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
HCl tác dụng với những chất nào?
1. Phản ứng với kim loại đứng trước H
HCl phản ứng với các kim loại đứng trước H trong bảng tuần hoàn như Fe, Al, Mg,…. giải phóng khí hiđrô và tạo muối clorua
2HCl + Mg → MgCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
6HCl + 2Al → 2AlCl3 + 3H2↑
2. Phản ứng với oxit kim loại
HCl tác dụng với các oxit kim loại như Al2O3, CuO, Fe3O4,…Sau phản ứng tạo ra muối và nước.
Fe3O4 + 8HCl → 4H2O + FeCl2+ 2FeCl3
6HCl + Al2O3 →2AlCl3 + 3H2O
2HCl + CuO → CuCl2 + H2O
3. Phản ứng với muối
Axit clohidric tác dụng với muối, sau phản ứng tạo ra muối mới và axit mới. Lưu ý: Để phản ứng xảy ra thì điều kiện chất cuối cùng là axit phải yếu hơn HCl, có kết tủa hoặc khí bay lên.
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + 2HCl → AgCl↓ + HNO3
2HCl + BaS → BaCl2 + H2S↑
K2CO3 + 2HCl → 2KCl + H2O + CO2↑
4. Phản ứng với oxit bazơ
Dung dịch HCl tác dụng với bazơ tạo muối clorua và nước.
2HCl + 2NaOH → 2NaCl + H2O
2HCl + Ca(OH)2 → CaCl2 + 2H2O
2HCl + Fe(OH)2 → FeCl2 + 2H2O

5. Phản ứng với hợp chất có tính oxi hóa
Acid HCl đóng vai trò là chất khử mạnh trong các phản ứng với các chất có tính oxi hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3… Phản ứng này tạo ra nước, khí clorua và muối clorua.
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
2HCl + MnO2 → MnCl2 + Cl2↑ + H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
HCl không tác dụng với chất nào?
Hóa chất HCl không phản ứng với các chất dưới đây:
-
Các kim loại đứng sau H trong bảng tuần hoàn như Cu. Ag, Au,….
-
Các loại muối không tan: muối gốc CO3 và PO4 nhưng trừ K2CO3 và Na2CO3,K3PO4 và Na3PO4)
-
Không tác dụng với tất cả các axit
-
Không tác dụng được với phi kim
-
Không tác dụng được với oxit kim loại
-
Không tác dụng được với oxit phi kim.
HCL được điều chế từ phương trình hóa học nào?
1. Tổng hợp trực tiếp
H2 + Cl2 → 2 HCl
Phản ứng diễn ra trong buồng đốt được cung cấp khí clo và hyđro ở nhiệt độ trên 2000 °C có mặt ngọn lửa. Hỗn hợp của hyđro và clo có khả năng gây nổ do đó cần những thiết bị đặc biệt có khả năng chịu nhiệt cao. Phương pháp này có chi phí rất cao.
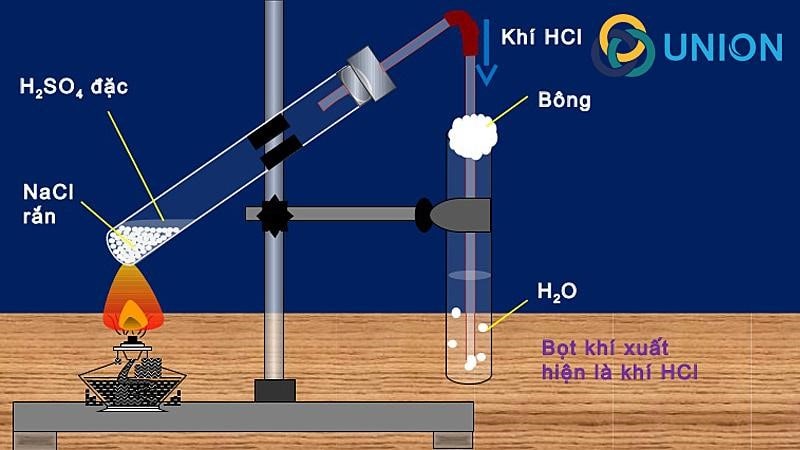
2. Từ clorua kim loại
Phản ứng với clorua kim loại, đặc biệt là natri clorua (NaCl), với axitsulfuric H2SO4) hoặc hydro sulfat dễ dàng điều chế HCl dạng khí. Phản ứng diễn ra gồm 2 giai đoạn, giai đoạn 1 ở nhiệt độ khoảng 150-250 °C, và giai đoạn 2 ở nhiệt độ khoảng 500 đến 600 °C.
NaCl + H2SO4 đặc → NaHSO4 + HCl↑
NaCl + NaHSO4 → Na2SO4 + HCl↑
Phương trình tổng hợp:
2 NaCl + H2SO4 → Na2SO4 + 2HCl↑
3. Clo hóa trong sản xuất chất hữu cơ
a. Nhiệt phân 1,2-dicloretan tạo thành vinyl clorua, 90% lượng axit clohiđric sản xuất ở Mỹ dùng phương pháp clo hóa này:
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 → C2H3Cl + HCl
b. Clorua hóa ankan, với R-là gốc hydrocacbon:
Cl2 + RH → RCl + HCl
c. Phản ứng trao đổi gốc clo với HF:
RCl + HF → RF + HCl
d. Tổng hợp tetrafloreten từ việc nhiệt phân Clodiflomêtan:
2 CHF2Cl → CF2=CF2 + 2 HCl
e. Từ đốt rác thải hữu cơ clo:
C4H6Cl2 + 5O2 → 4CO2 + 2H2O + 2HCl
4. Hydrat hóa clorua kim loại nặng
2FeCl3 + 6H2O → Fe2O3 + 3H2O + 6HCl
Ứng dụng phổ biến của Axit Clohidric trong đời sống
#1. Trong xử lý nước bể bơi
Đây là loại hóa chất thường được sử dụng để xử lý các vấn đề thường gặp trong nước bể bơi như mất cân bằng nồng độ pH, nước bị vẩn đục, nhiều vi khuẩn gây hại.
Chuẩn bị dụng cụ:
-
Dụng cụ vệ sinh: bộ cặn hút bể bơi bao gồm sào nhôm, bàn hút, chổi cọ, ống mềm hút cặn, vợt vớt rác.
- hóa chất HCl 32%, trợ lắng
Hóa chất xử lý cần có:, trợ lắng
-
Bộ test nước:để đo nồng độ pH và hàm lượng clo.
Các bước tiến hành:
Bước 1: Kiểm tra nồng độ hóa chất trong nước
Kiểm tra các chỉ tiêu pH và clo xem đã đảm bảo hay chưa (đối với pH từ 7.2 – 7.6, đối với Clo dư thì nồng độ dư lý tưởng là 0.6 – 1.5mg/l)
>>> Tham khảo chi tiết cách kiểm tra hóa chất trong nước tại:https://thietbibeboi.union.com.vn/thiet-bi-be-boi/thiet-bi-ve-sinh-be-boi/bo-test-thu-nuoc-be-boi-sps/

Bước 2: Thêm liều lượng để sốc Clo
– Biên pháp thủ công:
Hòa tan Hcl với nước, tỷ lệ thường là 1 – 4 lít HCL cho 100m3 hồ bơi (tỷ lệ hóa chất sẽ phụ thuộc vào tình trạng nước thực tế) rồi rải xung quanh bể, khuấy đều. Sau khi xử lý khoảng từ 4 – 6 tiếng mới được phép đưa hồ bơi vào sử dụng trở lại.
– Sử dụng thiết bị:
Thay vì tốn công, tốn sức ta dùng thiết bị châm hóa chất tự động Chemtrol 250 ORP/pH giúp ta kiểm soát dễ dàng liều lượng hóa chất khử trùng và điều chỉnh pH sao cho chuẩn xác.
Bước 3: Kiểm tra lại các thành phần hóa học trong nước. Nếu chưa đảm bảo cần tiến hành xử lý lại.
Trên đây là hướng dẫn xử lý nước bể bơi có pH cao hoặc thấp bằng Axit Clohydric 32%. Nếu bạn đọc cần hướng dẫn chi tiết hơn vui lòng liên hệ cho đội ngũ tư vấn viên của Union theo số hotline: 0888.176.539 để được hỗ trợ.

#2. Các ứng dụng khác của Axit Clohidric
Tẩy gỉ thép bằng HCl nồng độ 18%
Fe2O3+Fe+6HCl ⇒ 3FeCl2 + 3H2O
Sản xuất hợp chất hữu cơ như vinyl clorua và diclorometan, PVC hoặc than hoạt tính:
2CH2=CH2 + 4HCl + O2 → 2ClCH2CH2Cl + 2H2O
gỗ + HCl + nhiệt → than hoạt tính
Kiểm soát và trung hòa pH, điều chỉnh tính bazo trong dung dịch
OH− + HCl → H2O + Cl−
Một số ứng dụng khác:
-
Để sản xuất các hợp chất vô cơ theo phản ứng axit – bazo, ứng dụng trọng quá trình xử lý nước thải, kẽm clorua cho công nghiệp mạ và sản xuất pin.
-
Ứng dụng khác như xử lý da, vệ sinh nhà cửa, và xây dựng nhà.
-
Trong khai thác dầu, HCl được dùng để bơm vào các tầng đá của giếng dầu với mục đích hòa tan 1 phần đá, tạo lỗ rỗng lớn hơn
-
Một số phản ứng hóa học liên quan đến axit HCl được ứng dụng trong sản xuất thực phẩm, phụ gia thực phẩm như aspartame, fructose, axit citric, lysine.
-
Dùng HCl trong sinh vật: Axit Clohidric chứa trong axit gastric được tiết ra từ dạ dày sẽ tạo môi trường axit trong dạ dày từ 1 – 2.

Những lưu ý khi sử dụng và bảo quản axit clohidric
1. Lưu ý khi sử dụng axit HCl
-
Mang đầy đủ đồ bảo hộ: găng tay, kính mắt, khẩu trang, mặt nạ phòng độc,..khi tiếp xúc trực tiếp với Axit Clohidric.
-
Khi có tình trạng rơi vãi Axit clohidric cần sử dụng nước rửa sạch sẽ những vị trí vương vãi hóa chất đó.
-
Trường hợp không may hóa chất bắn vào người thì dùng ngay nước sạch rửa nhiều lần, nếu bắn vào các bộ phận nguy hiểm như mắt, mũi, miệng thì đến ngay các cơ sở y tế để xử lý kịp thời.

2. Khi bảo quản:
-
Nền kho chứa phải làm bằng vật liệu chịu được axit tốt.
-
Tuyệt đối không cho axit tiếp xúc với kim loại.
-
Bảo quản axit tại nơi khô ráo, thoáng mát, tránh nắng mưa trực tiếp.
-
Tuyệt đối không bảo quản chung với các chất dễ cháy, chất oxy hóa, đặc biệt là axit nitric hoặc Clo, xianua hoặc sulfua.
-
Các thùng chứa cần chắc chắn về mặt cơ học và chống ăn mòn, cần kiểm tra định kỳ để kiểm tra mức độ ăn mòn để thay thế. Không được bơm đầy hóa chất vào thùng chứa, cần đảm bảo ít nhất là 5% không gian chống.
-
Kho bãi phải có các biện pháp phòng tránh nguy cơ đổ vỡ hay rò rỉ axit ra ngoài.
Axit clohidric mua ở đâu chất lượng?
Như chúng ta đã biết, HCl là loại hóa chất được sử dụng vô cùng phổ biến, chính vì thế hiện nay trên thị trường xuất hiện rất nhiều đơn vị cung cấp hóa chất kém chất lượng, bảo quản không an toàn gây ảnh hưởng đến chất lượng của hóa chất khi sử dụng.
Công ty cổ phần Union là đơn vị có trên 5 năm kinh nghiệm trong lĩnh vực cung cấp hóa chất bể bơi. Mọi sản phẩm đều được bảo quản tại kho bãi đạt chuẩn, đầy đủ giấy tờ nguồn gốc xuất xứ, không lẫn các loại tạp chất khác gây nguy hiểm cho người sử dụng.
Trên đây là toàn bộ thông tin về hóa chất Axit Clohidric (HCl) được đội ngũ chuyên gia của Union biên soạn, hy vọng qua bài viết bạn đọc có thể hiểu rõ hơn và biết sử dụng loại axit HCl vào trong nhiều lĩnh vực của đời sống. Khi cần tư vấn rõ hơn về cách sử dụng cũng như mua hàng xin vui lòng liên hệ theo hotline 0888.176.539.











