Benzen là gì và những ứng dụng của benzen trong đời sống – cunghocvui
Mục lục bài viết
Benzen là gì và những ứng dụng của benzen trong đời sống
Benzen là gì và những ứng dụng của benzen trong đời sống
Trong bài học hôm nay chúng ta cùng tìm hiểu một chất hóa học đặc biệt, ít nhiều đã gây ra khó khăn cho mỗi chúng ta trong quá trình học và giải các bài tập liên quan. Nhận biết được vấn đề đó chúng tôi đã soạn nên bài giảng này với mong muốn giúp gỡ bỏ những thắc mắc cho các bạn!
I. Khái quát chung về Benzen
1. Benzen là gì?
Benzen trong điều kiện bình thường là một chất lỏng không màu, một hyđrocacbon thơm, dễ cháy, mùi dịu ngọt dễ chịu.
Công thức: \(C_6H_6\)
Điểm nóng chảy: 5,5 °C
Phân loại của EU: Ung thư nhóm 1; Đột biến nhóm 2; Độc (T)
Hợp chất liên quan: Toluen; Borazin
Khối lượng mol: 78,1121 g/mol
- Tính chất vật lý:
– Đặc tính cơ bản là chất lỏng rất linh động, không màu, nhiệt độ sôi là \(80^o C\), có mùi đặc trưng
– Là chất không tan trong nước, nhẹ hơn nước, nhưng tan nhiều trong các dung môi hữu cơ như ete, axeton, rượu.
– Có khả năng hòa tan nhiều chất như chất béo, cao su, \(Cl_2,Br_2,I_2, S, P,\)…
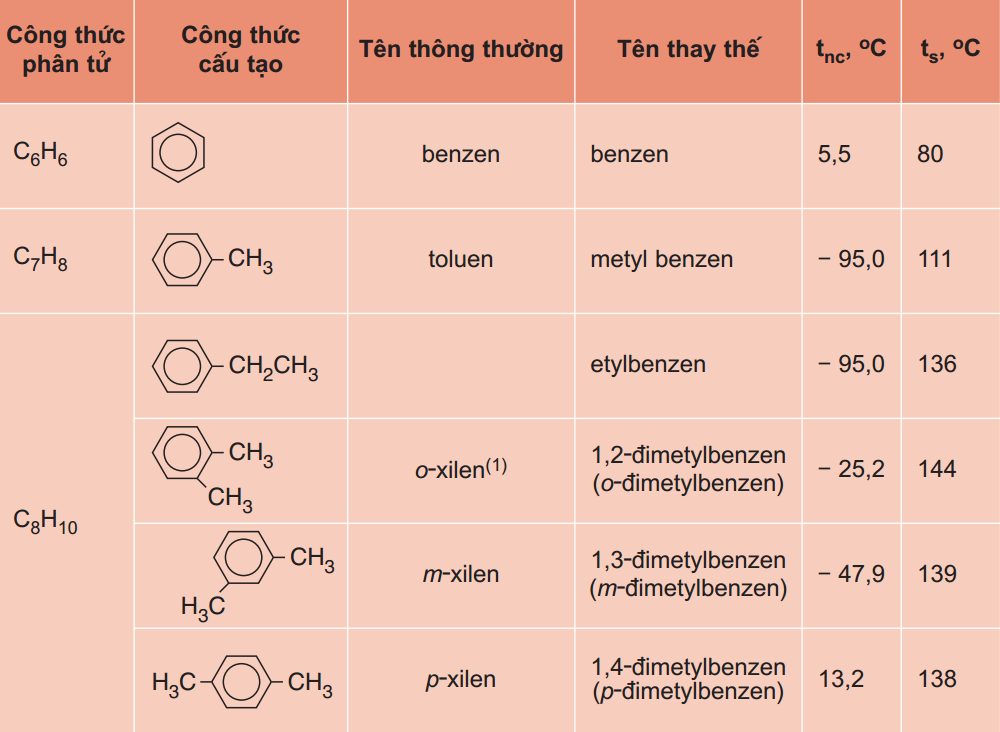
– Những đồng đẳng cơ bản của benzen tồn tại dưới dạng chất lỏng, những đồng đẳng cao hơn thì tồn tại dưới dạng chất rắn.
– Cùng với điều kiện xúc tác, là một dung môi hòa tan tốt.
- Benzen và đồng đẳng, vòng benzen
Bài học liên quan:
2. Nhận biết benzen
Để nhận biết được benzen ta sử dụng thuốc thử là hỗn hợp \(HNO_3\)đặc nóng hoặc \(H_2SO_4\)đặc.
Trong quá trình phản ứng ta nhận thấy chất lỏng có mùi hạnh nhân nổi trên bề mặt và có màu vàng thì đó chính là benzen.
II. Tính chất hóa học của benzen
Benzen có đặc trưng chính là tính thơm và tham gia cả phản ứng cộng và thế.
- Phản ứng thế
– Với halogen nguyên chất tác dụng với (\(Cl_2, Br_2\)) trong điều kiện nhiệt độ thường cùng với chất xúc tác là Fe ta có phản ứng benzen + Br2 như sau:
\(C_6H_6+Br_2 (Fe) \rightarrow C_6H_5Br+HBr\)
Chú ý: Benzen không có khả năng làm mất màu dung dịch Br2 trong điều kiện thường
– Phản ứng nitro hoá: là phản ứng benzen + HNO3. Với \(HNO_3\) bốc khói, có mặt \(H_2SO_4\) đặc, đun nóng nhẹ.
\(C_6H_6+HO-NO_2(H_2SO_4 đ)\rightarrow C_6H_5 – NO_2 +H_2O\)
– Phản ứng với dẫn xuất halogen
\(C_6H_6+CH_3-Cl(Al_3Cl_3 \ khan)\rightarrow C_6H_5-CH_3+HCl\)
\(C_6H_6+C_2H_5-Cl(Al_3Cl_3 \ khan)\rightarrow C_6H_5-C_2H_5+HCl\)
- Phản ứng cộng
Khó xảy ra hơn khi hiđrocacbon mạch hở và chưa no.
– Cộng \(H_2\)
\(C_6H_6+3H_2O (Ni, 180^0C)\rightarrow C_6H_{12} (xiclohexan)\)
– Cộng hỗn hợp clo và brom
\(C_6H_6+3Cl_2(askt)\rightarrow C_6H_6Cl_6 (hexaclohexan)\)
III. Điều chế benzen
- Điều chế từ axetilen ra benzen (Phản ứng trùng hợp)
\(3CH=CH (C, 600^o )\rightarrow C_6H_6\)
- Dùng Axit bezoic
\(C_6H_5COOH + NaOH \rightarrow C_6H_6 + Na_2CO_3\)
- ĐIều chế từ chưng cất nhựa than đá.
- Điều chế từ xiclohexan:
\(C_6H_{12}(Pt, 300^0)\rightarrow C_6H_6+3H_2\)
- Điều chế từ n – hexan:
\(C_6H_{14}(t^0, P, xt)\rightarrow C_6H_6+4H_2\)
IV. Ứng dụng của benzen
Benzen có vai trò rất quan trọng trong hóa học hữu cơ, được sử dụng làm nguồn nguyên liệu. Dùng trong tổng hợp các monome để tạo nên polime làm cao su, chất dẻo, tơ sợi (chẳng hạn cao su buna-stiren, polistiren, tơ capron). Ngoài ra, còn có thể điều chế Phenol từ benzen và điều chế từ benzen ra toulen.
– Toluen là thành phần quan trọng của thuốc nổ TNT (trinitrotoluen)
– Hợp chất toluen, benzen, các xilen ĐƯợc sử dụng phổ biến làm dung môi trong các phản ứng.
Trong quá trình xây dựng bài giảng chúng tôi rất mong muốn nhận được những thắc mắc phản hồi từ các bạn, để bài giảng trở lên hoàn thiện hơn. Chúc các bạn thành công!