HCl là gì? Tính chất hóa học & vật lí của axit clohiđric
HCl có ứng dụng quan trọng trong các ngành công nghiệp xử lý nước, sản xuất thực phẩm, sản xuất gang thép… Vậy HCl là gì, nó có những tính chất gì đặc biệt? Hãy cùng Manta.edu.vn tìm hiểu nội dung bài giảng Hiđro clorua, axit clohiđric và muối clorua trong bài viết dưới đây.
Nêu khái niệm HCl?
HCl là công thức chung của khí hiđro clorua và axit clohiđric. Phía trong:
-
Hiđro clorua HCl
Định nghĩa: Hiđro clorua là chất khí không màu, mùi hắc, tan nhiều trong nước (1 lít nước hòa tan được 500 lít HCl ở 20 độ C).
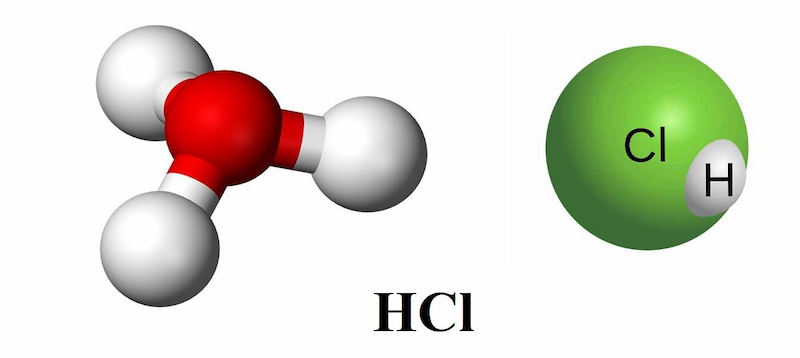
Cấu tạo phân tử: H – Cl. Hydro Clorua là một phân tử cộng hóa trị, phân cực.
-
Axit clohydric HCl
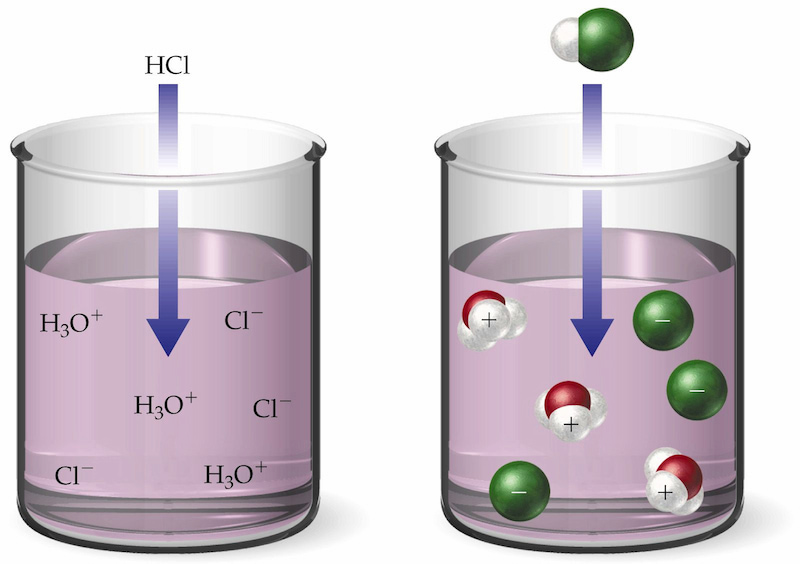
Hiđroclorua HCl tan trong nước tạo thành axit mạnh – Axit clohiđric HCl
Khái niệm: Axit clohydric HCL là chất lỏng không màu, mùi xốc, nồng độ đậm đặc nhất lên tới 37%.
Hiện tượng axit clohydric “bốc khói” trong không khí ẩm, do khí hiđro clorua thoát ra gặp hơi nước trong không khí tạo thành nhiều hạt dung dịch nhỏ như sương mù.
Tìm hiểu về hiđro clorua
Để nghiên cứu độ tan của khí HCl trong nước, người ta tiến hành thí nghiệm: Sục khí HCl vào đầy ống nghiệm, đậy miệng lọ bằng nút cao su. Xuyên một ống thủy tinh thẳng, nhọn xuyên qua nút cao su. Nhúng ống thủy tinh vào chậu nước có pha quỳ tím.
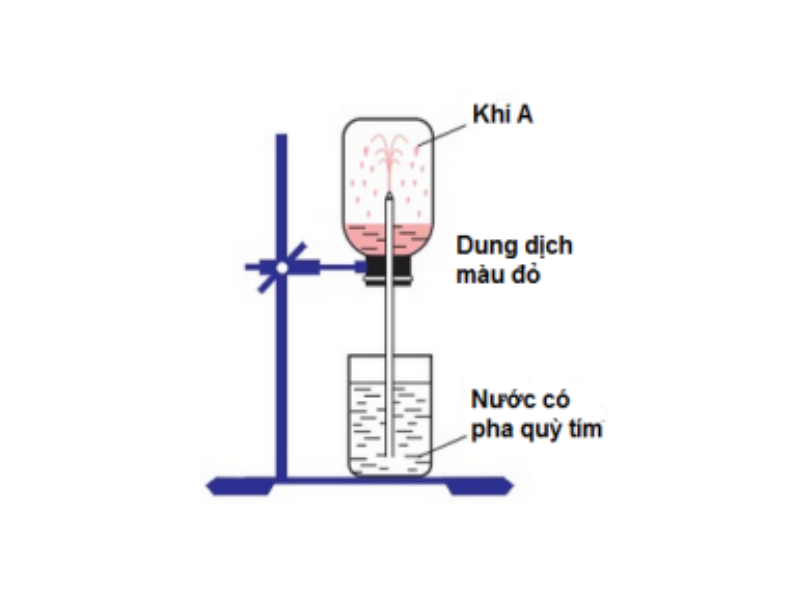
Quan sát được hiện tượng: Nước trong chậu theo ống phun lên những tia nước màu đỏ. Lý giải điều này, khí hiđro clorua tan nhiều trong nước làm áp suất trong bình giảm mạnh, áp suất khí quyển đẩy nước vào thay thế khí HCl đã hòa tan.
Vì vậy, chúng tôi có kết luận sau đây về Hydrogen clorua :
-
Khí HCl tan nhiều trong nước.
-
Khí HCl nặng hơn không khí (d= 36,5/29)
-
Khí HCl không làm quỳ tím hóa xanh. Dung dịch thu được là axit clohiđric có khả năng làm quỳ tím hóa đỏ.
-
Khí HCl không phản ứng với CaCO3.
Tìm hiểu thêm về axit clohydric HCl
Trong phần này chúng ta sẽ tìm hiểu chi tiết hơn về dung dịch axit clohidric HCl.

Tính chất vật lý của axit clohiđric
Dưới đây là 4 tính chất vật lý tiêu biểu của axit clohydric mà bạn cần nhớ:
-
Axit clohydric là dung dịch không màu, mùi hắc .
-
Dung dịch HCl đạt độ đặc nhất ở nồng độ C% = 37% (ở 20 độ C).
-
Dung dịch HCL hòa tan trong nước , D = 1,19(g/ml).
-
Dung dịch HCl đặc bốc khói trong không khí ẩm .
Tính chất hóa học của axit clohiđric
Axit clohiđric là một axit mạnh , có đầy đủ các tính chất của axit khi xảy ra các phản ứng sau:
-
Axit clohidric HCl làm quỳ tím hóa đỏ .
-
Axit clohiđric HCl phản ứng với kim loại đứng trước H tạo ra muối. Trong đó kim loại có hóa trị thấp + H2.
Ví dụ: Fe + 2HCl → FeCl2 + H2 (bay hơi)
Lưu ý: Pb đứng trước H nhưng không tan trong dung dịch HCl.
-
Axit clohidric HCl phản ứng với các oxit kim loại để tạo thành muối. Trong đó kim loại giữ nguyên hóa trị + H2O.
Ví dụ: Fe3O4 + 8HCl → 4H2O + FeCl2 + 2FeCl3
-
Axit clohydric HCl phản ứng với bazơ tạo thành muối . Trong đó kim loại giữ nguyên hóa trị + H2O.
Ví dụ: Fe(OH)2 + 2HCl → FeCl2 + 2H2O
-
Axit clohiđric HCl phản ứng với muối tạo ra muối mới + axit mới.
Ví dụ: Na2CO3 + 2HCl → 2NaBr + H2O + CO2
Ngoài là một axit mạnh, HCl còn thể hiện tính oxi hóa khử :
-
Tính oxi hóa : HCL thể hiện tính oxi hóa khi kết hợp với các kim loại đứng trước H.
-
Tính khử : Tính khử này thực hiện được vì trong phân tử HCl, clo có số oxi hóa thấp nhất là -1. Khi cho dung dịch HCl đặc phản ứng với các chất oxi hóa mạnh như: KMnO4, K2Cr2O7, MnO2, KClO3,… thì HCl bị oxi hóa thành Cl2 theo phương trình:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
(+4) (-1) (+2) (0)
Cách điều chế axit clohiđric?
Cách điều chế axit clohiđric? Cùng tìm hiểu 2 phương pháp điều chế HCl phổ biến: Trong công nghiệp và trong phòng thí nghiệm.
Mục lục bài viết
Điều chế axit clohidric HCl trong phòng thí nghiệm
Trong phòng thí nghiệm, người ta điều chế HCl bằng phương pháp sunfat – cho tinh thể NaCl phản ứng với H2SO4 đặc và đun nóng, rồi hấp thụ vào nước.
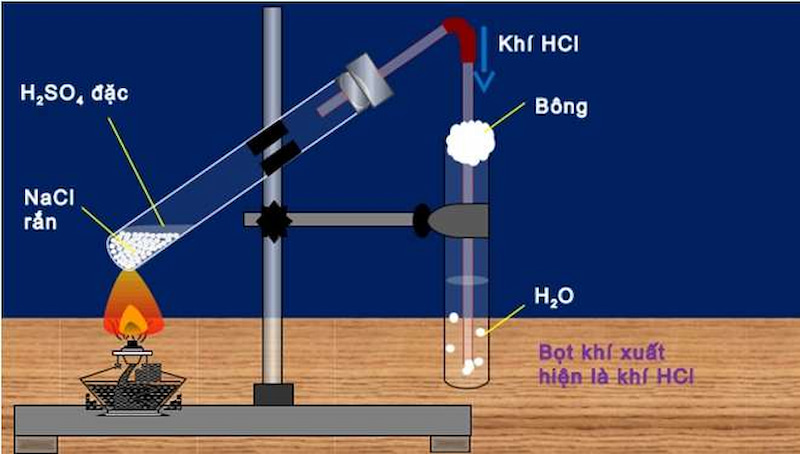
Phương trình phản ứng như sau:
NaCl + H2SO4 → NaHSO4 + HCl (nhiệt độ < 250 độ C)
2NaCl + H2SO4 → Na2SO4 + 2HCl (nhiệt độ từ 400 độ C trở lên)
Sản xuất công nghiệp axit clohydric
Trong công nghiệp, HCl được điều chế bằng cách đốt cháy H2 trong khí quyển Cl2. Trong đó cả hai chất đều là sản phẩm của quá trình điện phân NaCl có màng ngăn.
H2 + Cl2 → 2HCl (nhiệt độ)
Ứng dụng của axit clohydric HCl
Với những tính chất vật lý và hóa học như trên, axit clohiđric HCl được ứng dụng như thế nào trong đời sống?

-
Trong công nghiệp : HCl 35% được sử dụng rộng rãi trong các ngành công nghiệp luyện gang thép, xi mạ, sản xuất chitin, luyện kim, hàn điện, sản xuất cao su, chế biến thực phẩm (đường, bột ngọt, nước mắm). ), công nghiệp hóa chất và xử lý nước, nhà máy điện, công nghiệp khai khoáng…
-
Tẩy rỉ sét trên sắt thép : Đây là ứng dụng phổ biến và thiết thực nhất trong đời sống của axit HCl. Trước khi đưa thép vào sản xuất, người ta sẽ sử dụng HCl với nồng độ ~18% để tẩy rỉ thép Carbon, giúp thép trở nên mới. Bên cạnh đó, người ta đã phát minh ra quá trình tái chế HCl để tiết kiệm và nâng cao hiệu quả tẩy gỉ sắt thép theo phương trình:
4FeCl2 + 4H2O + O2 → 8 HCl + 2Fe2O3. Fe2O3 (sắt oxit) cũng là sản phẩm phụ có nhiều ứng dụng trong công nghiệp.
-
Công dụng trong sản xuất các hợp chất vô cơ : Axit HCl được dùng trong sản xuất các hợp chất vô cơ bằng nhiều phản ứng hóa học. Thông thường, hóa chất xử lý nước như FeCl3, PAC,… được dùng làm chất keo tụ, dùng trong xử lý nước thải, nước uống và sản xuất giấy.
-
Sản xuất các hợp chất hữu cơ : HCl cũng có thể được sử dụng để tạo ra vinyl clorua và dichloroethane trong sản xuất PVC. Ngoài ra, nó còn được dùng trong sản xuất bisphenol A, sản xuất polycarbonate, axit ascorbic, than hoạt tính và một số dược phẩm.
-
Kiểm soát, trung hòa pH : Trong các ngành đòi hỏi độ tinh khiết (sản xuất dược phẩm, thực phẩm, dược phẩm, nước uống…) người ta dùng dung dịch HCl nồng độ cao để điều chỉnh nồng độ. pH của nước. Đối với các ngành công nghiệp khác, axit clohydric công nghiệp được dùng để trung hòa nước thải, xử lý nước hồ bơi.
-
Tái sinh nhựa trao đổi ion : HCL chất lượng cao được ứng dụng trong tái sinh nhựa trao đổi ion. Điều này được áp dụng trong tất cả các ngành công nghiệp hóa chất, sản xuất đồ uống và một số ngành công nghiệp thực phẩm. HCL trở nên phổ biến để loại bỏ các ion như Na+, Ca2+ khỏi dung dịch nước để tạo ra nước khử khoáng, thông qua việc thay thế Na+ bằng H+, Ca2+ bằng 2 H+.
-
Đối với sinh vật : Axit clohydric HCL có trong dạ dày như một chất chống vi khuẩn, ngăn ngừa nhiễm trùng và hỗ trợ quá trình tiêu hóa. Khi độ pH trong dạ dày thấp, các protein trong dạ dày bị biến tính, tạo điều kiện cho các enzym tiêu hóa phân giải thức ăn dễ dàng hơn, đồng thời kích hoạt các tiền enzym pepsinogen thành enzym hoạt hóa pepsin theo cơ chế tự phân. cắt tỉa.
-
Các ứng dụng khác : Trong công nghiệp khai thác dầu, HCl được bơm vào lớp đá của giếng dầu để hòa tan một phần đá và tạo ra các lỗ rỗng lớn. HCl có khả năng hòa tan vàng và bạch kim khi trộn với axit nitric đậm đặc theo tỷ lệ mol 1:3. Axit clohydric còn là nguyên liệu trong sản xuất một số sản phẩm như: Aspartame, axit citric, lysine, fructose, protein thực vật thủy phân, gelatin….
Sơ lược về muối clorua
Muối của axit clohidric HCl được gọi là muối clorua có công thức chung là: MCln.

-
Tính tan: Hầu hết các muối clorua đều tan trong nước, trừ PbCl2, AgCl, CuCl và Hg2Cl2.
-
Ứng dụng : Muối clorua có nhiều ứng dụng quan trọng như: Dùng làm phân kali (KCl), chống thối gỗ do ZnCl2 có khả năng diệt khuẩn, làm chất xúc tác trong tổng hợp các hợp chất hữu cơ (AlCl3), diệt sâu bệnh. bệnh (BaCl2). NaCl là nguyên liệu quan trọng trong công nghiệp hóa chất để điều chế hydro, clo và được dùng làm muối ăn, bảo quản thực phẩm.
-
Nhận biết : Để nhận biết muối clorua ta dùng thuốc thử AgNO3 tạo kết tủa trắng theo phương trình: AgNO3 + NaCl → AgCl + NaNO3.
Tổng hợp các phản ứng hóa học thường gặp nhất với HCl
Để ghi nhớ kiến thức về hiđro clorua, axit clohiđric và muối clorua, sau đây là các phản ứng hóa học cơ bản và phổ biến nhất với HCl.
-
HCl tác dụng với kim loại
2HCl + Mg → MgCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
6HCl + 2Al → 2AlCl3 + 3H2↑
Na + 2HCl → NaCl + H2↑
Zn + 2HCl → ZnCl2 + H2↑
-
HCl tác dụng với oxit kim loại
Fe3O4 + 8HCl → 4H2O + FeCl2+ 2FeCl3
6HCl + Al2O3 → 2AlCl3 + 3H2O
MnO2 + HCl → MnCl2 + Cl2 + H2O
K2Cr2O7 + 14HCl → 2CrCl3 + 2KCl + 3Cl2 + 7H2O
KClO3 + 6HCl → 3Cl2 + KCl + 3H2O
-
HCl phản ứng với bazơ
2HCl + 2NaOH → 2NaCl + H2O
2HCl + Ca(OH)2 → CaCl2 + 2H2O
2HCl + Fe(OH)2 → FeCl2 + 2H2O
2HCl + Mg(OH)2 → MgCl2 + 2H2O
NH3 + HCl → NH4Cl (có khói trắng bay ra)
-
HCl phản ứng với oxit bazơ
MgO + 2HCl → MgCl2 + H2O
2HCl + CuO → CuCl2 + H2O
-
HCl tác dụng với muối
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
K2CO3 + 2HCl → H2O + CO2 + 2KCl
AgNO3 + HCl → AgCl↓ + HNO3
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Xem thêm:
- Nhóm halogen là gì? Vị trí, đặc điểm, tính chất, cấu hình electron
- Iốt là gì? Thuộc tính và ứng dụng phổ biến nhất
Bài tập HCl SGK có lời giải chi tiết
Sau khi đã nắm vững những kiến thức cơ bản về hiđro clorua, axit clohiđric và muối clorua, các em hãy cùng tham khảo Giải một số bài tập về HCl trong SGK Hóa học 10 Bài 23. Hi vọng lời giải chi tiết, dễ hiểu nhất dưới đây sẽ giúp ích cho các em. Đọc thêm về bài học này.

Giải bài 1 trang 106 SGK Hóa học 10
Cho 20g hỗn hợp bột Mg và Fe phản ứng với dung dịch HCl dư thấy thoát ra 1g khí H2. Khối lượng muối clorua tạo ra trong dung dịch là?
A. 40,5 gam.
B. 45,5 gam.
C.55,5 gam.
D. 65,5 gam.
Trả lời : Đáp án C đúng.
Chúng ta có:
n(H2) = 1/2 = 0,5 mol.
Mg + 2HCl → MgCl2 + H2
Fe + 2HCl → FeCl2 + H2
n(Mg)= x; n(Fe) = y.
n(H2) = x + y = 0,5 mol.
mhh = 24x + 56y = 20 gam.
Giải hệ phương trình ta có x = y = 0,25 mol.
mMgCl2 = 0,25 × 95 = 23,75 gam.
mFeCl2 = 0,25 × 127 = 31,75g
Khối lượng muối clorua = 23,75 + 31,75 = 55,5
Giải bài 2 SGK Hóa 10 trang 106
Nêu tính chất vật lí của khí hiđro clorua HCl.
Câu trả lời:
Hiđro clorua là chất khí không màu, mùi hắc, nặng hơn không khí. Khí hiđro clorua tan nhiều trong nước tạo thành dung dịch axit. Ở 20oC 1 thể tích nước hòa tan được 500 thể tích khí hiđro clorua.
Giải bài 3 SGK Hóa học 10 trang 106
Có các chất sau: Axit sunfuric đặc, nước, kali clorua đặc. Viết các phương trình phản ứng điều chế hiđro clorua.
Câu trả lời:
Phương trình hóa học của phản ứng điều chế hiđro clorua
2NaCl (tinh thể) + H2SO4 (đậm đặc) → Na2SO4 + 2HCl (nhiệt độ)
2KCl + 2H2O → 2KOH + H2 + Cl2 (điện phân dung dịch có màng ngăn)
H2 + Cl2 → 2HCl (ánh sáng)
Giải bài 4 trang 106 SGK Hóa học 10
Trích dẫn các phản ứng hóa học của axit clohydric làm ví dụ.
a) Đều là phản ứng oxi hoá – khử.
b) Không phải là phản ứng oxi hoá – khử.
Câu trả lời:
a) Ví dụ về axit clohydric như một phản ứng oxy hóa-khử là:
Là chất khử:
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
K2Cr2O7 + 14HCl –> 2CrCl3 + 2KCl + 3Cl2 + 7H2O
KClO3 + 6HCl –> 3Cl2 + KCl + 3H2O
Là một tác nhân oxy hóa:
Mg + 2HCl → MgCl2 + H2↑
Mg + 2HCl → MgCl2 + H2↑
Fe + 2HCl → FeCl2 + H2↑
b) Ví dụ không phải là phản ứng oxi hóa khử của axit clohiđric:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
CuO + 2HCl → CuCl2 + H2O.
Giải bài 5 SGK Hóa 10 trang 106
Sự khác nhau giữa bản chất của các phản ứng điều chế hiđro clorua bằng phương pháp sunfat và phương pháp tổng hợp? Các phương pháp trên dựa vào tính chất hóa học nào của các chất phản ứng?
Câu trả lời:
Thực chất của phương pháp sunfat hóa là dùng phản ứng trao đổi: NaCl + H2SO4 → NaHSO4 + HCl.
Thực chất của phương pháp tổng hợp là dùng phương pháp hóa học (phản ứng oxi hóa – khử):
H2 + Cl2 → 2HCl.
Như vậy, bài viết này đã giúp bạn trả lời câu hỏi HCl là gì và cung cấp những kiến thức nền tảng quan trọng về hiđro clorua, axit clohiđric và muối clorua. Manta.edu.vn hi vọng những thông tin trên sẽ giúp các bạn hiểu rõ hơn về HCL và có thể làm thành thạo các bài tập liên quan đến chất này trong tương lai. Bấm “ NHẬN CẬP NHẬT ” ở đầu trang để không bỏ lỡ những bài học thú vị khác!