Oxi là gì? Tính chất, cách điều chế và ứng dụng của oxy trong đời sống
5.1 Vai trò của oxy với sự sống của con người và động vật
Tiếp nối các chuỗi bài viết về chất khí là gì? Khí argon là gì ? Co2 là gì?,… Bài viết dưới đây Song Mã sẽ giới thiệu cho bạn một vài thông tin về khí Oxi.
Về cơ bản, chúng ta cần khí Oxi để duy trì sự sống. Trong điều kiện bình thường Oxi không màu, không mùi và không vị. Ứng dụng quan trọng nhất của khí Oxi chính là hô hấp và đốt nhiên liệu. Vậy chất khí O2 là gì? Theo dõi ngay bài viết dưới đây, bạn sẽ ngạc nhiên hơn nữa về tầm quan trọng không thể thiếu của nguyên tố hóa học này.

Mục lục bài viết
1. Định nghĩa oxi là gì?
Oxi là gì? Oxi (tên tiếng Anh là Oxygen) là nguyên tố hóa học có ký hiệu là O2. Nguyên tử khối là 16 và phân tử khối là 32. Oxi có số hiệu nguyên tử là 8, thuộc nhóm VIA, chu kì 2 của bảng tuần hoàn các nguyên tố hóa học.
Oxi là nguyên tố phổ biến xếp hàng thứ 3 trong vũ trụ theo khối lượng sau hydro và heli và là nguyên tố phổ biến nhất theo khối lượng trong vỏ Trái Đất, chiếm gần một nửa vỏ Trái đất ở dạng oxide. Khí oxi chiếm 20,9% về thể tích trong không khí.
Oxy liên tục được bổ sung trong bầu khí quyển của Trái đất bằng quá trình quang hợp, sử dụng năng lượng của ánh sáng mặt trời để tạo ra oxy từ nước và carbon dioxide.
Tính chất của Oxi là một chất khí không mùi, không vị rất khó để nhận ra bằng mắt thường và có ở xung quanh chúng ta trên bầu khí quyển, trong không khí. Oxy giúp duy trì sự sống trên trái đất,thể hiện sự sống còn và tồn tại của con người và các loại động, thực vật trên trái đất. Chính vì thế mà oxy là một chất khí cực kì quan trọng và không thể thiếu được.
Bạn đã hiểu rõ oxy là gì. Vậy tính chất vật lý của Oxi là gì? Cùng tiếp tục tìm hiểu ở phần tiếp theo bạn nhé!
2. Tính chất vật lý của oxygen
Tính chất vật lý của Oxi là một chất không mùi, không màu, không vị. Oxi tan ít trong nước và có khối lượng nặng hơn không khí. Khi chịu áp suất của khí quyển thì oxi sẽ hóa lỏng ở -183 độ. Khí hóa lỏng sẽ có màu xanh nhạt.
Oxi tan rất ít trong nước. Nước ở nhiệt độ 20 độ C với 100ml, 1atm sẽ hoà tan được 3,1ml oxi. Khí oxi ở 20 độ C và 1atm sẽ có độ tan là 0,0043g tỉ trọng 100g H2O.
Oxy là một chất dễ phản ứng và phải được cất giữ cách xa các vật liệu dễ cháy.
Vậy tính chất hoá học của Oxi cụ thể ra sao? Cùng tiếp tục tìm hiểu thông tin ở phần tiếp theo bạn nhé!
Xem thêm:
3. Tính chất hóa học của oxi
3.1 O2 tác dụng với kim loại
Phản ứng đặc trưng của oxi là phản ứng cháy. Ở điều kiện bình thường hay điều kiện phức tạp thì hầu hết oxi đều phản ứng với kim loại để tạo ra các oxit (trừ kim loại vàng và bạch kim oxi không phản ứng). Đương nhiên, nếu ở điều kiện bình thường thì phản ứng sẽ xảy ra lâu hơn.
Oxi có thể tác dụng với hầu hết các kim loại dưới tác dụng của nhiệt độ.
3.2 O2 tác dụng với phi kim
Trong mỗi điều kiện khác nhau thì oxi tác dụng với khá nhiều loại phi kim trong tự nhiên, trừ nhóm halogen (Flo, Clo, Brom, Iot và Atatin) là Oxi không phản ứng, và sản phẩm được tạo thành là các oxit axit.
2 nguyên tố phi kim tác dụng với Oxi được biết đến nhiều nhất là photpho (P) và lưu huỳnh(S).
Oxi tác dụng với photpho: Photpho cháy rất mạnh trong không khí và tạo ra ngọn lửa sáng chói, có một lượng lớn khói màu trắng bám vào thành lọ. Bột trắng này có thể tan được trong nước và có kí hiệu là P2O5 ( điphotpho pentaoxid).
Oxi tác dụng với lưu huỳnh: Lưu huỳnh cháy trong oxi rất mãnh liệt, tạo ra ngọn lửa nhỏ màu xanh nhạt. Phản ứng sản xuất ra khí lưu huỳnh đi-o-xít(SO2) và có rất ít khí lưu huỳnh trioxit (SO3) .
3.3 O2 tác dụng với hợp chất
Cùng tìm hiểu công thức hoá học của oxi. Phổ biến nhất của tác dụng này đó là phản ứng cháy của khí metan có trong khí bioga, bùn ao với oxi, tỏa rất nhiều nhiệt.
Tác dụng với các chất có tính khử:
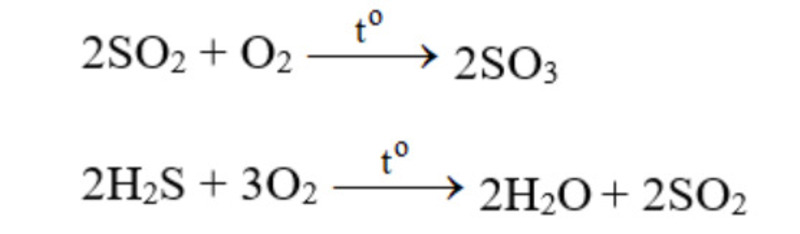
Tác dụng với các chất hữu cơ:
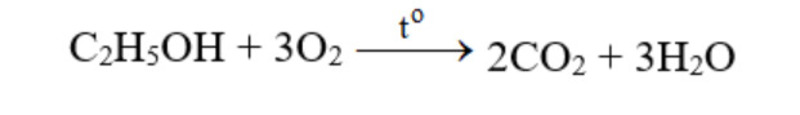
4. Điều chế oxygen như thế nào?
Có nhiều cách để điều chế oxi, tùy vào mục đích sử dụng. Dưới đây là những cách điều chế, sản xuất oxi trong phòng thí nghiệm và trong công nghiệp phổ biến nhất.
4.1 Điều chế oxi trong phòng thí nghiệm
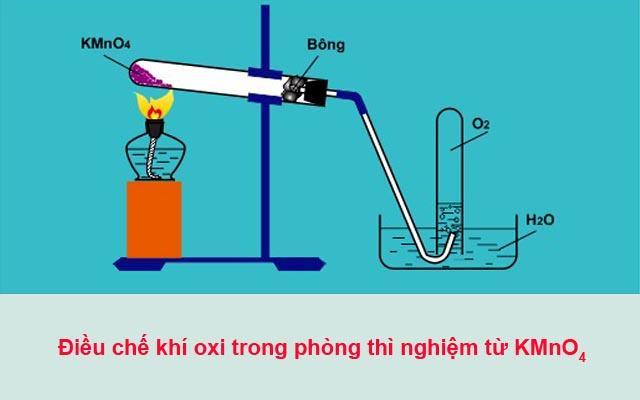
Trong phòng thí nghiệm, khí oxi được điều chế bằng cách phân hủy những hợp chất giàu oxi và ít bền đối với nhiệt như KMnO4 (rắn), KClO3 (rắn)…
- 2KMnO4 → K2MnO4 + MnO2 + O2 (Điều kiện: Nhiệt độ)
Lưu ý khi điều chế Oxi trong phòng thí nghiệm:
Nếu điều chế O2 trong phòng thí nghiệm bằng cách nhiệt phân chất rắn thì lắp ống nghiệm sao cho miệng ống nghiệm hơi hướng xuống để đề phòng hỗn hợp có chất rắn ẩm, khi đun hơi nước không chảy ngược lại làm cho vỡ ống nghiệm.
Khi ngừng thu khí, phải tháo rời ống dẫn khí rồi mới tắt đèn cồn để tránh hiện tượng nước tràn vào ống nghiệm khi ngừng đun. Trong trường hợp thu khí O2, để kiểm tra O2 đã đầy bình hay chưa, ta sẽ đưa tàn đóm đỏ vào miệng bình thấy bùng cháy thì chứng tỏ O2 đã đầy bình.
4.2 Điều chế oxi trong công nghiệp
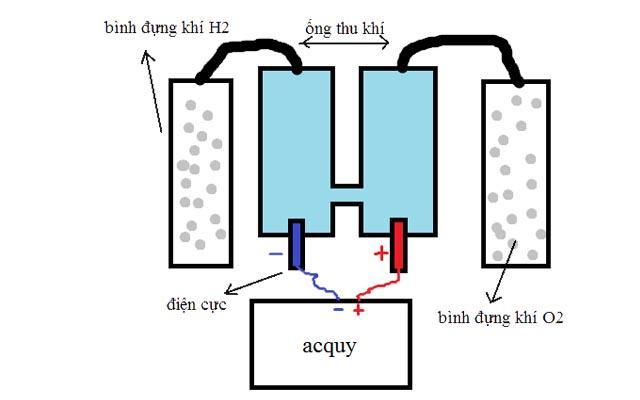
Có 2 cách để sản xuất oxi trong công nghiệp đó là sản xuất từ không khí và từ nước.
- Sản xuất oxi từ không khí: Không khí sau khi đã loại bỏ hết nước, bụi, khí cacbon đioxit, được hóa lỏng. Chưng cất phân đoạn không khí lỏng sẽ thu được oxi. Oxi được vận chuyển trong những bình thép có dung tích 100 lít dưới áp suất 150 atm.
- Sản xuất oxi từ nước: Tiến hành điện phân nước (nước có hòa tan một lượng nhỏ H2SO4 hoặc NaOH để tăng tính dẫn điện của nước), chúng ta thu được khí oxi ở cực dương và khí hidro ở cực âm: 2H2O → (điện phân) 2H2 + O2 (k)
Không thể áp dụng tráo đổi 2 quy trình vì điều chế trong công nghiệp cần lượng lớn oxi với giá thành rẻ trong khi ở phòng thí nghiệm chỉ cần 1 lượng nhỏ.
5. Ứng dụng của oxi trong đời sống
5.1 Vai trò của oxy với sự sống của con người và động vật
Oxi có nhiều ứng dụng quan trọng, vai trò của oxi quyết định sự sống của con người và động vật. Mỗi ngày, chúng ta cần khoảng 20-30m3 khí oxi để duy trì sự sống. Toàn bộ tế bào sống đều liên quan đến oxy, đối với tất cả các tế bào sống của con người cần được cung cấp oxy liên tục nếu không chúng sẽ chết trong vòng vài phút.
Những thợ chữa cháy, phi công hay thợ lặn khi thực hiện nhiệm vụ đều cần ứng dụng của oxi cho việc thở chứa trong các bình đặc biệt, vì càng lên cao không khí càng loãng.
Oxy có thể được sử dụng như một chất khử trùng để tiêu diệt một số vi khuẩn kỵ khí khi tiếp xúc đủ với khí.
5.2 Ứng dụng oxy trong công nghiệp – đốt nhiên liệu

Ứng dụng của oxi trong công nghiệp đốt nhiên liệu còn thể hiện qua hoạt động chế tạo mìn phá đá, oxi lỏng dùng để đốt nhiên liệu trong tên lửa.
Một ứng dụng khá gần gũi của oxi trong công nghiệp luyện gang thép là thổi khí oxi để tạo nhiệt độ lớn hơn, nâng cao hiệu suất và chất lượng của gang và thép. Khí CO được tạo ra cho phép khử oxit sắt thành các hợp chất sắt tinh khiết hơn.
Oxy được sử dụng trong các ứng dụng khác liên quan đến kim loại và yêu cầu nhiệt độ cao, chẳng hạn như mỏ hàn.
Sử dụng oxy trong không gian vũ trụ. Ở dạng lỏng, oxy được sử dụng rộng rãi như một chất oxy hóa để sử dụng trong tên lửa, nơi nó phản ứng với hydro lỏng để tạo ra lực đẩy cần thiết cho việc cất cánh. Bộ đồ du hành vũ trụ bao gồm một dạng oxy gần như tinh khiết.
Oxy được sử dụng để phân hủy các hợp chất hydrocacbon, chúng bị phân hủy bằng cách đốt nóng chúng. Điều này được sử dụng để tạo ra quá trình đốt cháy thường giải phóng nước và carbon dioxide, nhưng cũng có thể tạo ra hydrocacbon axetylen, propylene và ethylene.
Trên đây Song Mã Việt đã tổng hợp và chia sẻ về định nghĩa khí Oxi, O2 là gì? tính chất và ứng dụng vào các lĩnh vực đời sống. Vai trò của oxi rất cần thiết nhưng vì có sẵn trong tự nhiên nên thường ít ai nhận ra chúng quan trọng đến mức nào. Hy vọng bài viết trên đây đã giải đáp được những thắc mắc của bạn.











