Qui tắc alpha (α) và dãy điện hóa của kim loại – W3CHEM
Điều kiện xảy ra phản ứng oxi hóa – khử rất khó hiểu; nhưng khi dùng qui tắc alpha (α) để minh hoạ, lại trở nên thật dễ thương đến không ngờ! Mời bạn đọc để hiểu hơn.
Qui tắc alpha giúp mình viết nhanh và đúng phương trình của phản ứng oxi hóa-khử.
1. Cặp trạng thái đối lập của con người
Bạn đã biết, một người có nhiều trạng thái tâm lý, thể chất khác nhau: vui, buồn, yêu, ghét, mạnh khỏe, yếu đau, … Chúng ta có thể biểu diễn 1 cặp trạng thái đối lập ở dạng ghê ghê như sau:
- Vui/Buồn.
- Yêu/Ghét.
Một điều đương nhiên trong mỗi cặp trạng thái trên; nếu trạng thái này mạnh thì trạng thái kia phải yếu. Ví dụ,
- nếu trạng thái Vui là mạnh mẽ; thì trạng thái Buồn là yếu
- nếu trạng thái Yêu là yếu; thì trạng thái Ghét đang mạnh.
2. Cặp oxi hóa / khử là gì?
Các chất oxi hóa-khử cũng vậy. Ứng với cùng một nguyên tố sẽ có các dạng oxi hóa, dạng khử khác nhau. Người ta biểu diễn 1 cặp trạng thái OXI HÓA/KHỬ giống như trên (nghĩa là chất oxh ghi trước; rồi sẹc 1 cái; rồi ghi chất khử!).
Cũng cần nhắc lại câu: Khử tăng; O (oxi hóa) giảm để mình xác định đúng chất chất oxi hóa-chất khử.
Từ đó ta có các cặp oxi hóa/khử như các ví dụ:
Chỉ có 1 cặp oxh/khử nếu nguyên tố chỉ có 1 số oxi hóa
- Na chỉ có soh là +1 ⇒ 1 cặp oxh/khử là Na+/Na0.
- Al chỉ có soh là +3 ⇒ 1 cặp oxh/khử là Al3+/Al0.
Có nhiều cặp oxh/khử nếu nguyên tố có nhiều số oxi hóa
- Xét Cu có 2 số oxh +1, +2 ⇒ các cặp oxh/khử là Cu+/Cu ; Cu2+/Cu ; Cu2+/Cu+.
- Xét Fe có 2 số soh +2, +3 ⇒ các cặp oxh/khử là Fe3+/ Fe ; Fe2+/Fe ; Fe3+/Fe2+.
Cũng giống như trên, nếu chất oxi hóa là mạnh mẽ; thì trạng thái khử sẽ yếu đuối và …ngược lại.
- Ví dụ ở cặp Ag+/Ag: ion Ag+ có tính oxh rất mạnh thì ngược lại, kim loại Ag có tính khử rất yếu.
- Ví dụ ở cặp Na+/Na: ion Na+ có tính oxh rất yếu thì kim loại Na ngược lại, có tính khử rất mạnh.
3. Làm sao chúng mình so sánh được tính oxi hóa, tính khử ?
Các nhà khoa học phải dùng thực nghiệm và máy móc đo đạc; chúng mình chỉ lấy kết quả sử dụng thôi.
Ví dụ trên với 2 cặp oxh/khử Fe2+/Fe và Cu2+/Cu, các nhà hóa học có kết quả so sánh sau:
- tính oxi hóa của
Fe2+
<
Cu2+
- tính khử của
Fe
>
Cu
4. Dãy điện hóa của kim loại-dãy so sánh tính oxi hóa khử dọn sẵn
Dãy điện hoá xếp theo chiều tăng dần tính oxi hoá và chiều giảm dần tính khử các cặp oxh/khử của kim loại.
Mục đích là giúp viết phản ứng oxi hóa khử cho nhanh khi áp dụng qui tắc α mình sẽ học ở các mục sau.

Photo: TrongToan on W3chem
Để dễ nhớ, mình học lời vàng ý ngọc sau:
Lắm Khi Ba Cô Nàng Mong Ăn Me Zốt Cần Fải (Fe2+/Fe) Cố Nhớ Sang Phố Hỏi (H) Cụ Sắt 3 (Fe3+/Fe2+) Bạc Hàng Phi Âu (Bạn có thể sáng tác bản khác nếu muốn).
Đương nhiên, ưu tiên phản ứng giữa chất khử mạnh nhất + chất oxi hoá mạnh nhất (nhớ: càng xa nhau phản ứng càng dễ!)
5. Điều kiện xảy ra phản ứng oxi hóa – khử
5.1. Các bạn thân mến,
phản ứng oxi hóa khử xảy ra khi chất cho electron (gọi là chất khử) gặp chất nhận electron (gọi là chất oxi hóa). Tuy nhiên, không phải cứ chất khử gặp chất oxi hóa là phản ứng xảy ra; mà phải thỏa điều kiện sau:
OXI HOÁ MẠNH + KHỬ MẠNH → oxh yếu + khử yếu [*]

Mặc dù gặp 3 chàng trai; nhưng nàng chỉ yêu anh bọ gậy còm cõi và xấu trai. Có lẽ …anh ấy thỏa vài điều kiện nào đó của cô ta …ít nhất là áo cùng màu!
Ví dụ, phản ứng CuSO4 + Fe → FeSO4 + Cu
+Các bé lớp 8, 9, 10 nói: Fe là kim loại mạnh nên đẩy được kim loại Cu yếu hơn ra khỏi dung dịch muối.
+Lớp 11 viết được phương trình ion: Cu2+ + Fe → Fe2+ + Cu
+Lớp 12 mình vừa học so sánh:
- tính oxi hóa của
Fe2+
<
Cu2+
- tính khử của
Fe
>
Cu
- nên phản ứng xảy ra là
Cu2+ (oxh mạnh) + Fe (khử mạnh) → Fe2+ (oxh yếu) + Cu (khử yếu)
⇒ Lớp 12 nay đã lớn, học bài này xong, nói: phản ứng trên xảy ra được vì thoải điều kiện phản ứng oxi hoá-khử [*] (đương nhiên phản ứng ngược lại hổng xảy ra).
5.2. Bài tập viết cho đúng phản ứng oxh-khử
Vui lòng viết cho đúng phản ứng oxi hóa khử xảy ra giữa hai cặp oxh/khử sau:
a) Mg2+/Mg và Ag+/Ag.
b) Al3+/Al và Ag+/Ag.
c) Al3+/Al và Cu2+/Cu.
d) Ag+/Ag và Fe3+/Fe2+.
e) Fe3+/Fe2+ và Cu2+/Cu.
f) Fe3+/Fe2+ và Fe2+/Fe.
g) Mg2+/Mg và Fe3+/Fe2+.
6. Qui tắc alpha có dễ thương không?
6.1.
Qui tắc α là gì vậy?
Thay vì phải nhớ qui tắc [*] khi viết phản ứng oxi hóa khử; nhà hóa học nghĩ ra trò vẽ chữ alpha-gọi là qui tắc α (giúp viết phản ứng đúng-gọn-nhanh) như sau:
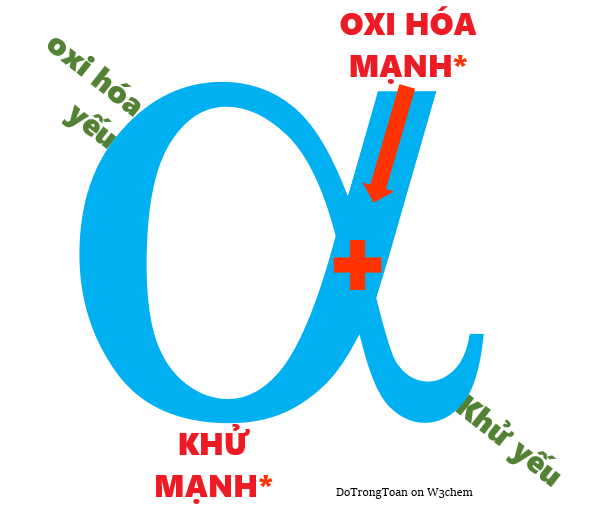
Qui tắc alpha vừa đẹp, vừa dễ thương và dễ nhớ cho điều kiện xảy ra phản ứng oxi hóa khử
(Photo: TrongToan on W3chem)
Muốn vậy, người ta phải xếp hai dãy, trong đó
- Dãy trên có tính oxi hóa mạnh dần
- Dãy dưới có tính khử yếu dần
Hai dãy này các nhà hóa học đã xếp cho mình rồi đó, hãy xem lại mục 4. Dãy điện hóa …
6.2. Quy tắc alpha đúng dễ thương luôn
+Ví dụ mình xem lại ví dụ trên, đã biết
- tính oxi hóa của
Fe2+
<
Cu2+
- tính khử của
Fe
>
Cu
- nên phản ứng xảy ra là
Cu2+ (oxh mạnh) + Fe (khử mạnh) → Fe2+ (oxh yếu) + Cu (khử yếu)
Hãy vẽ chữ α vào mục so sánh, không biết bạn có thấy gì không?
+Như vậy, mình chỉ cần viết đúng thứ tự chất oxi hóa, chất khử như ở mục 4. Dãy điện hóa … ; rồi vẽ chữ α vào là viết ngay được phản ứng xảy ra.
7. Phản ứng của kim loại với dung dịch Fe3+ từ qui tắc alpha
Rất khó để có được bảng tổng kết sau đây; nhưng nếu bạn suy nghĩ đôi chút, cũng chỉ từ qui tắc alpha và dãy điện hóa của kim loại mà thôi!

Photo: TrongToan on W3chem
Nhớ MÃI không QUÊN nhưng luôn… MÃI QUÊN 3 phản ứng sau:
-
Fe + 2Fe3+ → 3Fe2+
-
Cu + 2Fe3+ → Cu2+ + 2Fe2+
-
Fe2+ + Ag+ → Fe3+ + Ag
8. Vui khỏe với vài bài toán qui tắc alpha
8.1. (CĐ 2013) Hỗn hợp X gồm FeCl2 và NaCl có tỉ lệ số mol tương ứng là 1 : 2.
Hòa tan hoàn toàn 2,44 gam X vào nước, thu được dung dịch Y. Cho Y phản ứng hoàn toàn với dung dịch AgNO3 dư, thu được m gam chất rắn. Giá trị của m là
A. 2,87.
B. 5,74.
C. 6,82.
D. 10,80.
X = 2,44 gam {x mol FeCl2 ; 2x mol NaCl} => ra x = 0,01
Tổng Cl– = 0,04 mol ; Fe2+ = 0,01 mol
Phản ứng xảy ra gồm
- Trao đổi ion đã học ở lớp 11
Ag+ + Cl– → AgCl rắn
- Phản ứng mãi quên vừa học ở trên
***HAY QUÊN***
Ag+ + Fe2+ → Fe3+ + Ag rắn
Tính mrắn gồm
- AgCl = 143,5.0,04 = 5,74 gam
-
Ag
= 0,01.108 = 1,08 gam - Vậy m = AgCl + Ag = 6,82 gam
8.2. (ĐH B 2013) Nhúng một thanh sắt vào dung dịch hỗn hợp chứa
0,02 mol AgNO3 và 0,05 mol Cu(NO3)2. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng thanh sắt tăng m gam (coi toàn bộ kim loại sinh ra bám vào thanh sắt). Giá trị của m là
A. 2,00.
B. 3,60.
C. 1,44.
D. 5,36.
Áp dụng mol tăng = mol giảm, ta có
- Fe tăng từ 0 lên 2 (Fe dư; do cuối TN ta lấy thanh Fe ra, cân lại mà!)
- Giảm gồm: Ag+ giảm 1 xuống 0 ; Cu2+ giảm 2 xuống 0
- Mol Fetan.2 = Ag+.1 + Cu2+.2 => Fetan = 0,06mol ~ 3,36 gam
Agbám + Cubám = 5,36 gam
Vậy Fe tăng = kim loạibám vào Fe – lượngFe tan = 5,36 – 3,36 = 2 gam
8.3. Cho 300 ml dung dịch AgNO3 vào 200 ml dung dịch Fe(NO3)2.
Sau khi phản ứng xảy ra hoàn toàn, thu được 19,44 gam chất rắn X và dung dịch Y. Trong Y, số mol của Fe(NO3)3 gấp đôi số mol Fe(NO3)2. Dung dịch Y phản ứng được với tối đa m gam hỗn hợp kim loại Al và Mg (tỉ lệ số mol tương ứng là 1 : 3). Giá trị của m là
A. 11,88.
B. 8,91.
C. 7,92.
D. 5,94.
AgNO3 + Fe(NO3)2 → Fe(NO3)3 + Ag => rắn X = Ag = 0,18 mol
Fe(NO3)3 = Ag = 0,18 => Fe(NO3)2 dư = 0,09
Đặt Al = x mol ; Mg = 3x mol
- Mol tăng = mol giảm => 3x + 3x.2 = 0,18.3 + 0,09.2
- Giải ra x = 0,08
- Vậy m = x.27 + 3x.24 = 7,92 gam
9. Liên kết nhanh
Đọc thêm các bài viết về Kim loại và Hóa lớp 12 tại đây.
Nếu có câu hỏi hoặc ý tưởng mới, hãy lưu lại trong phần bình luận bạn nhé. Câu hỏi và ý tưởng của bạn luôn tuyệt vời.
Cũng đừng quên chia sẻ bài viết lên mạng xã hội để nhiều người cùng học nha bạn.
Chia sẻ bài viết lên mạng xã hội
Mục lục bài viết