Rượu etylic (C2H6O) là gì? Tính chất, cấu tạo phân tử, Cách điều chế
Rượu etylic (công thức hóa học C2H6O) thu được sau quá trình lên men gạo, sắn, ngô (đã nấu chín) hoặc nho, táo… Hãy cùng tìm hiểu tính chất, cấu tạo phân tử, ứng dụng và điều chế rượu etylic. chất này.
Rượu etylic là gì?
Rượu etylic (rượu etylic hoặc etanol) là một chất lỏng không màu, còn được gọi là rượu ngũ cốc hoặc rượu, là một hợp chất hữu cơ trong dãy đồng đẳng của rượu, dễ cháy, một trong những loại rượu phổ biến. chứa trong thành phần của đồ uống có cồn.
-
Công thức phân tử: C2H6O
-
Khối lượng phân tử: 46
-
Cấu trúc phân tử:
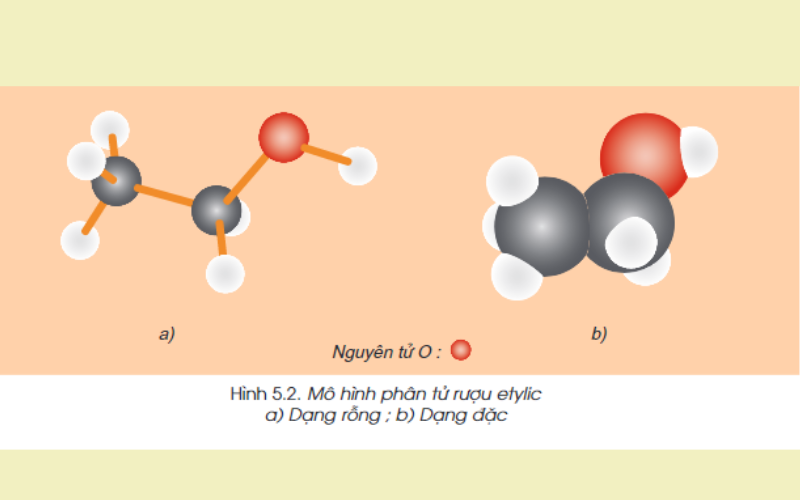
Công thức cấu tạo rút gọn: CH3-CH2-OH
Trong phân tử ancol etylic có nguyên tử H không liên kết với nguyên tử C mà liên kết với nguyên tử Oxy tạo thành nhóm -OH. Chính nhóm -OH này đã tạo cho rượu những tính chất hóa học đặc trưng.
Tính chất vật lí của rượu etylic
Rượu etylic (C2H6O) có các tính chất vật lý sau:
-
Rượu etylic là chất lỏng không màu, sôi ở 78,3 độ C, nhẹ hơn nước, tan vô hạn trong nước.
-
Rượu etylic hòa tan được nhiều chất như iot, benzen,…
-
Số ml rượu etylic có trong 100ml hỗn hợp rượu và nước gọi là độ mạnh của rượu. Ví dụ 100ml rượu 45 độ chứa 45ml rượu etylic nguyên chất.
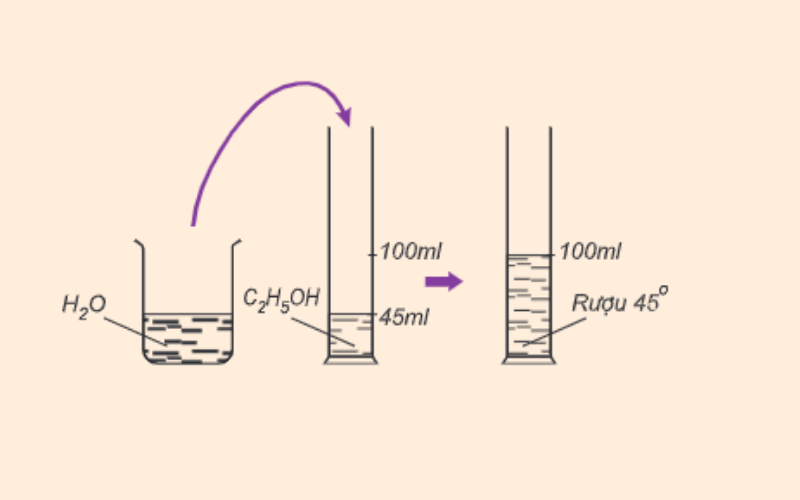
Công thức tính độ cồn như sau:
Độ cồn = Vr/Vhh x 100
Trong đó:
-
dr là độ cồn (độ)
-
Vr là thể tích rượu etylic (ml)
-
Vhh là thể tích của hỗn hợp rượu và nước (ml)
Công thức tính nồng độ cồn hoàn chỉnh là nồng độ cồn = 100%. Độ rượu càng lớn thì dung dịch chứa nhiều rượu etylic và ngược lại.
Tính chất hóa học của rượu etylic
Với đặc điểm liên kết như trên, rượu etylic có 3 tính chất hóa học đặc trưng được chứng minh qua thí nghiệm chi tiết sau:

Phản ứng mạnh với oxi khi đun nóng
Ta tiến hành thí nghiệm nhỏ vài giọt rượu etylic vào cốc sứ rồi đốt. Khi đốt cháy rượu etylic ta sẽ thấy ngọn lửa màu xanh và tỏa nhiều nhiệt. Lúc này, rượu etylic phản ứng mạnh với oxi khi đun nóng, tạo thành phản ứng cháy.
Phản ứng xảy ra theo phương trình sau:
C2H6O (l) + 3O2 (k) (nhiệt độ) → 2CO2 (k) + 3H2O (h)
Phản ứng với natri
Ta tiến hành thí nghiệm cho một mẫu natri vào cốc (ống nghiệm) đựng rượu etylic. Quan sát thí nghiệm trên ta thấy có bọt khí bay ra, mẫu natri tan dần. Do đó, giống như nước, rượu etylic phản ứng với natri, giải phóng khí hydro.
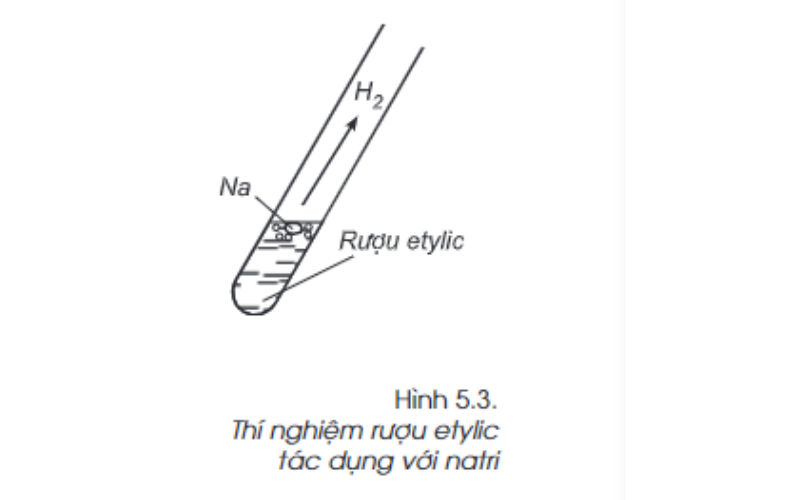
Phản ứng diễn ra như sau:
2C2H5OH(l) + 2Na(r) → 2C2H5ONa(dd) + H2(k)
Rượu này có thể phản ứng hóa học với kim loại mạnh như K hoặc Na.
Phản ứng với axit axetic
Ta tiến hành thí nghiệm cho ancol etylic, axit axetic vào ống nghiệm A. Thêm một ít axit sunfuric đặc làm xúc tác. Đun sôi hỗn hợp một lúc thì dừng lại. Thêm một ít nước vào phần hơi nước ngưng tụ trong ống nghiệm B, lắc nhẹ rồi quan sát.
Ta sẽ quan sát hiện tượng: Trong ống nghiệm B có chất lỏng không màu, mùi thơm, không tan trong nước, nổi trên mặt nước. Chứng tỏ rượu etylic tác dụng với axit axetic tạo ra etyl axetat. Đây là chất lỏng, có mùi thơm, ít tan trong nước, được dùng làm dung môi trong công nghiệp.
Phản ứng diễn ra như sau:
C2H5OH + CH3COOH CH3COOC2H5 + H2O ( H2S04 đặc, nhiệt độ)
Hai cách điều chế rượu etylic
Tùy theo nhu cầu của chúng ta mà rượu etylic có 2 cách pha chế như sau:

Cách 1: Rượu etylic được pha chế dưới dạng nước giải khát
Để điều chế rượu làm nước giải khát, người ta phối hợp tinh bột hoặc glucozơ, nhờ men xúc tác thu được rượu etylic theo phương trình sau:
Tinh bột/đường (men) —> Rượu etylic
Phương pháp 2: Sản xuất cồn công nghiệp
Để điều chế rượu dùng trong công nghiệp, người ta cho etilen vào nước có xúc tác axit theo phương trình sau:
CH2 = CH2 + H2O (axit) → C2H5OH
Chú ý: Các hợp chất hữu cơ, phân tử có nhóm OH, có công thức phân tử chung là CnH2n+1OH, được gọi là rượu hoặc ankanol đơn chức, cũng có tính chất tương tự rượu etylic.
Ứng dụng của rượu etylic
Rượu etylic, ngoài công dụng phổ biến nhất là đồ uống, còn có những công dụng bổ sung quan trọng sau.

-
Là nguyên liệu để sản xuất dược phẩm , cồn, cao su tổng hợp, axit axetic.
-
Rượu etylic được dùng làm dung môi pha chế vecni , nước hoa.
-
Được sử dụng làm nhiên liệu cồn (thường được trộn với xăng) và trong nhiều quy trình công nghiệp khác. Rượu etylic cũng có thể được sử dụng trong các sản phẩm chống đông do điểm đóng băng thấp đặc trưng của nó.
-
Dung dịch chứa cồn etylic 70% được sử dụng làm chất khử trùng , gel làm sạch kháng khuẩn phổ biến nhất ở nồng độ 62%. Cồn etylic được dùng để khử trùng rất tốt khi dùng ở dung dịch khoảng 70%, nồng độ cao hơn hoặc thấp hơn thì khả năng kháng khuẩn kém hơn. Rượu etylic giết chết sinh vật chủ yếu bằng cách làm biến tính protein và hòa tan chất béo của chúng. Ngoài ra, nó có hiệu quả chống lại vi khuẩn và nấm cùng với nhiều loại vi-rút nhưng ít hiệu quả hơn đối với bào tử vi khuẩn.
Bài tập rượu etylic SGK Hóa học 9 có lời giải
Từ những kiến thức về ancol etylic (C2H6O) ở trên, các em có thể vận dụng những kiến thức đó để giải một số bài tập cơ bản trong SGK hóa học 9 sau đây.

Giải bài 1 trang 139 SGK Hóa học 9
Rượu etylic tác dụng với natri vì:
A. Phân tử chứa một nguyên tử oxi.
B. Trong phân tử có nguyên tử hiđro và nguyên tử oxi.
C. Trong phân tử có nguyên tử cacbon, hiđro và oxi.
D. Trong phân tử có nhóm –OH.
Câu trả lời gợi ý:
Đáp án: D. Đáp án A, B, C sai.
Giải bài 2 SGK Hóa 9 trang 139
Trong số các chất sau: CH3 – CH3, CH3 – CH2OH, C6H6, CH3 – O – CH3 chất nào phản ứng được với Na? Viết phương trình hóa học.
Câu trả lời gợi ý:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
Giải bài 3 SGK Hóa học 9 trang 139
Có ba ống nghiệm: ống 1 đựng rượu etylic, ống 2 đựng rượu 96o, ống 3 đựng nước. Cho Na dư vào các ống nghiệm trên, viết các phương trình hóa học.
Câu trả lời gợi ý:
Phương trình phản ứng hóa học:
Ống 1: Rượu etylic tác dụng với Na
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Ống 2: Cồn 96o phản ứng với Na gồm C2H5OH và H2O phản ứng với Na
2H2O + 2Na → 2NaOH + H2
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Ống 3: Nước phản ứng với Na
2H2O + 2Na → 2NaOH + H2
Giải bài 4 trang 139 SGK Hóa học 9
Trên chai rượu có đánh số, ví dụ 45 độ, 18 độ, 12 độ.
a) Giải thích ý nghĩa của các số trên.
b) Tính số ml rượu etylic có trong 500ml chai rượu 45 độ.
c) Từ 500ml rượu 45 độ pha được bao nhiêu lít rượu 25 độ.
Câu trả lời gợi ý:
a) Các số 45 độ, 18 độ, 12 độ cho biết trong 100ml có 45ml, 18ml, 12ml rượu nguyên chất.
b) Số ml rượu etylic có trong 500ml rượu 45o là: (500 x 45)/100 = 225ml
c) 900ml = 0,9 lít
Theo câu b): Trong 500ml rượu 45o có 225ml rượu nguyên chất.
⇒ Số ml rượu 25o pha được từ 500ml rượu 45o (hoặc từ 225ml rượu nguyên chất) là: (225 x 100)/25 = 900ml
Bài viết trên đã cung cấp đầy đủ thông tin về tính chất, cấu tạo phân tử, ứng dụng và điều chế rượu etylic (C2H6O) – một chất vô cùng phổ biến xung quanh chúng ta. Hi vọng những thông tin này sẽ giúp các bạn có thêm những kiến thức bổ ích và áp dụng chúng trong học tập cũng như trong thực tế.











