T NG H P Cao Su Buna S .Hayeu | PDF
Tiểu luậ
n
h
ợ
p
c
h
ậ
t
t
r
u
n
g
g
i
ậ
n
I
.
G
i
ớ
i
t
h
i
ệ
u
v
ề
c
a
o
s
u
b
u
n
a
S
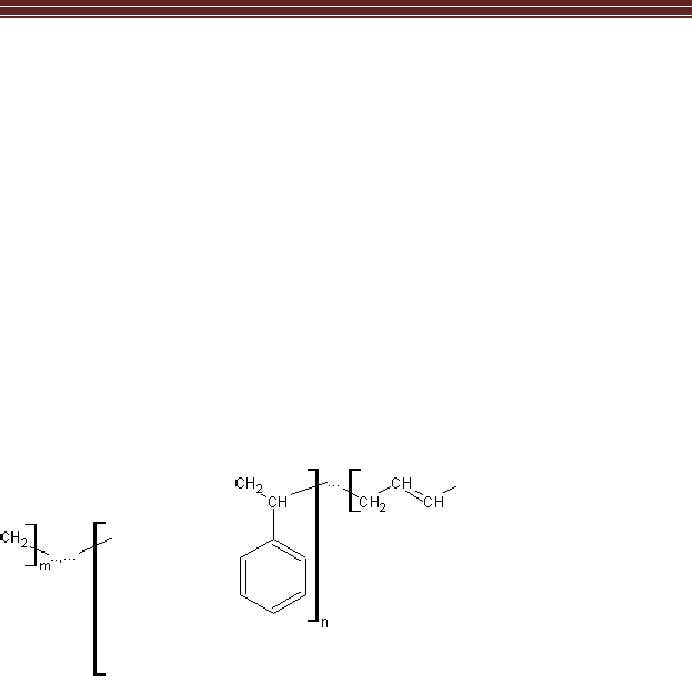
1.
Th
àn
h p
hầ
n h
óa
họ
c
Công thức
2.
Lị
ch
sử
ph
át
tr
iể
n
–
Cao s
u sty
ren
-bu
tađ
ien c
òn g
ọi là c
ao su b
una S
là m
ột lo
ại ca
o su
tổng hợp. Nó được viết tắt là
SBR
(
Styrene Butadiene Rubber
) là
chất đồng trùng hợp từ 2 đồng phân là
butadiene và styren. Nó
được nhà hóa học người Đức Walter Bock tổng hợp thành công lần
đầu tiên vào năm 1929 bằng phương pháp polymer nhũ tương hai
cấu tử này. Nó cũng là loại
cao su tổng hợp đầu tiên có khả
năng
sử dụng ở quy mô kinh tế-thương mại.
3.
Ứng
dụn
g t
ron
g t
hực
tế
–
SBR l
à lo
ại ca
o su tổ
ng hợ
p đượ
c sử d
ụng n
hiề
u nhấ
t ch
iếm h
ơn
45% tổng lượng cao su tiêu thụ trên toàn cầu.
Trong đó, ứng dụng
sản xuất lốp xe là nhiều nhất và
tiêu thụ trên 75% lượng SBR sản
xuất trên thế giới.
–
Ngo
ài r
a, SB
R còn
đượ
c ứng
dụn
g làm
ngu
yên
liệ
u để s
ản xu
ất r
ất
nhiều vật dụng khác như giày dép,chất kết dính, các thiết bị
máy
móc: trục máy in, tấm lót bàn phím, tấm đệm, ….
4
.
Tí
nh
ch
ấ
t
–
Nhi
ệt đ
ộ chu
yển t
iếp
thủ
y ti
nh (T
g) c
ủa S
BR và
o kho
ảng –
55
o
C
phụ thuộc vào hàm
lượng styrene.
–
Nh
iệ
t đ
ộ s
ử d
ụn
g :
-4
0 đ
ến
10
0
o
C
–
Đ
ộ g
iã
n d
à
i (
%)
: 4
5
0-
50
0
5.
Nh
u c
ầu
sử
dụ
ng
[
T
y
p
ể
t
ể
x
t
]
P
ậ
g
ể
1















Tiểu luậ
n
h
ợ
p
c
h
ậ
t
t
r
u
n
g
g
i
ậ
n
–
Do n
hu cầ
u tr
ong n
gàn
h côn
g ngh
iệp c
hế t
ạo lố
p xe t
ang l
ên, d
ẫn
đến nhu cầu tiêu thụ SBR tăng đều
đặn trong suốt 10 năm qua. Từ
3.286.677 tấn năm 2000 lên 4.571.201 tấn năm 2010 và dự kiến
đạt 8.201.902 tấn/ năm vào năm 2020.
–
Ngh
iên
cứu v
ào n
ăm 20
10 ch
o thấ
y các n
gàn
h côn
g ngh
iệp
sản
xuất lốp xe chiếm 3.363.045 tấn, giày dép chiếm 315.770 tấn, xây
dựng chiếm 247.000 tấn; tức là chúng chiếm đến hơn 85% nhu cầu
SBR trên toàn thế giới.
II
.
Cá
c ph
ươ
ng p
há
p sả
n xu
ất m
on
om
er
.
1.
Sản
xuấ
t b
uta
die
ne
–
B
u
t
a
d
i
e
n (
t
0
s
=-4,413
0
C, d
20
4
=0,6211) là một sản phẩm hóa dầu phổ biến, nhờ
đó là sự phát triển của các loại polyme đồng trùng hợp với styren và
acrylonitril. Quá trình sản xuất butadien gần đây nhất là từ acetylene và
formaldehyt (Germa
ny, the Reppe process) hoặc sản xuất
bằng phương pháp
aldol hóa acetandehyt (Germany), hoặc dehydrat hóa, dehydro hóa etanol
(USSR, United States: Union
Carbide)
–
Các p
hươ
ng ph
áp sả
n xuấ
t ngà
y nay đ
i từ ng
uyê
n liệ
u dầu m
ỏ. Tạ
i châ
u Âu
và Nhật, butadien được phân tác từ phân đoạn C
4
của quá trình steam
craking. Tại Mỹ, nó có thể được sản xuất bằng cách dehydro hóa n-butan và
đặc biệt là n-buten trong phân đoạn C
4
từ cracking xúc tác
1.
1.
De
hy
dr
o h
óa
xú
c t
ác
tr
ực
ti
ếp
Butadien từ dehydro hóa vẫn cung cấp 1/15 sản lượng trên tòan thế giới năm
1981, nhưng đến năm 1990, phương pháp tổng hợp này gần như không còn xuất
hiện. Đầu tiên là từ buten, sau đó từ butan trong 2 giai đoạn với nguyên liệu
trung gian là buten và cuối cùng trong 1 giai đoạn
1.1.1
.
Dehy
dro hó
a bute
n có xúc
tác
[
T
y
p
ể
t
ể
x
t
]
P
ậ
g
ể
2
Tiểu luậ
n
h
ợ
p
c
h
ậ
t
t
r
u
n
g
g
i
ậ
n
Chuẩn bị
nguyên liệu
T
i
n
h
c
h
ế
b
u
t
a
d
i
e
n
T
h
u
h
ồ
i
s
ả
n
p
h
ẩ
m
n
h
ẹ
H
2
-C
3
polymer
butadien
Hơi nước
Hơi nước quá nhiệt
Buten tuần hòan
Flue gas
Tháp phản ứng
Tháp phản ứng
Hệ thống thiết bị gia nhiệt
Không khí đã gia nhiệt
(chỉ cho xúc tác Dow)
Phân đoạn C4
buten
Gia nhiệt buten
Công nghệ sản xuất butadien bằng phương pháp dehydro hóa buten
a.
Các
điề
u k
iện
của
quá
trì
nh
Buten chỉ có trong hỗn hợp trong phân đoạn C
4
(25 đến 45 phần trăm
khối lượng) gồm n-buten, iso-buten, n-butan và iso-butan. Để đạt yêu cầu
cho quá trình dehydro hóa, nồng độ n-buten trong nguyên liệu phân đoạn C
4
phải
ít
nhất
70%,
có
thể
là
80-95%.
Bởi
vì
từ
sự
chuyển
hóa
buten
thành
butadien chỉ xảy ra một phần trong mỗi đoạn xúc tác, phần chưa chuyển hóa
phải được
tuần hoàn
lại. Vì
thế các
hydrocacbon C
4
phải được giới hạn đến
mức có thể, để tránh làm mất một số lượng buten chưa được chuyển hóa
trong phần cặn.
Sự dehydro hóa xảy ra theo phản ứng sau:
2
2
3
2
2
2
3
3
C
H
C
H
C
H
C
H
C
H
C
H
C
H
C
H
H
C
H
C
H
C
H
C
H
Phản ứng là cân bằng, thu nhiệt. Do đó phản
ứng thích hợp ở nhiệt độ cao
và áp suất thấp
[
T
y
p
ể
t
ể
x
t
]
P
ậ
g
ể
3











